2026年薪火金卷高考仿真模拟卷化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年薪火金卷高考仿真模拟卷化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
12. 根据下列实验操作和现象所得到的结论不正确的是(
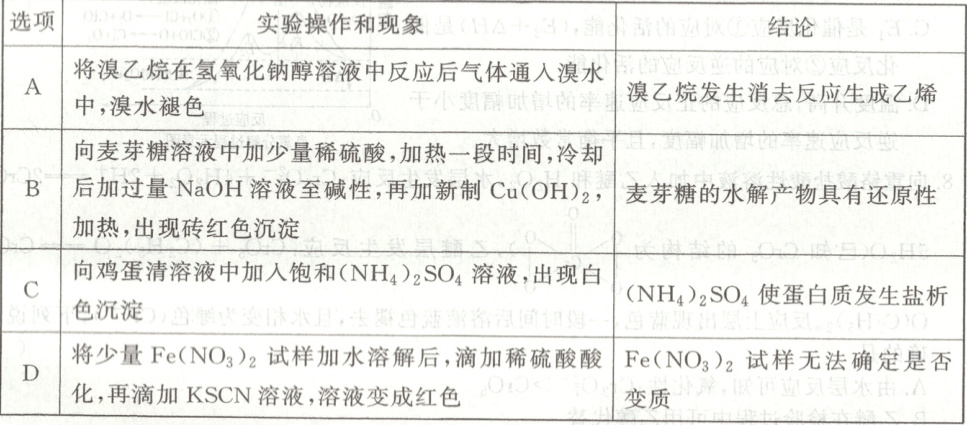
B
)
答案:
12.B [溴乙烷在${NaOH}$醇溶液中发生消去反应生成乙烯,气体可使溴水褪色,结论合理,A正确;麦芽糖本身是还原性糖,若水解不完全,未水解的麦芽糖在碱性条件下可直接与新制${Cu(OH)_{2}}$反应生成砖红色沉淀,无法证明水解产物的还原性,结论错误,B错误;饱和${(NH_{4})_{2}SO_{4}}$溶液使蛋白质盐析,现象与结论一致,C正确;酸性条件下${NO^{-}_{3}}$会氧化${Fe^{2+}}$为${Fe^{3+}}$,导致溶液变红,无法判断${Fe(NO_{3})_{2}}$是否变质,结论正确,D正确。]
13. 双极膜是由阳离子交换膜和阴离子交换膜复合而成的,其内层为水层,装置工作时水层中的$H_2O$解离成$H^+$和$OH^-$,分别向两侧发生迁移。$CO_2$电化学还原法制备甲醇的电解原理如图所示。该装置工作时,下列说法正确的是(
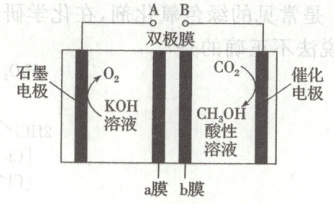
A.电极A是电源的负极
B.$OH^-$穿过b膜进入右室溶液
C.催化电极的电极反应:$CO_2-6e^-+6H^+\xlongequal{}CH_3OH+H_2O$
D.当催化电极生成64g甲醇时,左侧电极室质量增加108g
D
)
A.电极A是电源的负极
B.$OH^-$穿过b膜进入右室溶液
C.催化电极的电极反应:$CO_2-6e^-+6H^+\xlongequal{}CH_3OH+H_2O$
D.当催化电极生成64g甲醇时,左侧电极室质量增加108g
答案:
13.D [由图可知,左侧电极$-2$价氧失去电子发生氧化反应,为电解池的阳极,右侧电极二氧化碳得到电子发生还原反应,为电解池的阴极。左侧电极为阳极,则${A}$为正极,A错误;右侧电极为阴极,左侧电极为阳极,在电解池中阴离子向阳极移动,则${OH^{-}}$穿过${a}$膜进入左室溶液,B错误;催化电极为阴极,由图可知,电极反应为${CO_{2} +6e^{-} +6H^{+}\xlongequal{}CH_{3}OH +H_{2}O}$,C错误;$64\ {g}$甲醇的物质的量为$2\ {mol}$,根据选项C分析可知,此时转移$12\ {mol}$电子,根据分析可知,左侧电极有如下对应关系${O_{2}}~4{e^{-}}~4{OH^{-}}~\Delta m(36)$,则当此时转移$12\ {mol}$电子时,左侧电极室质量增加$\dfrac{12}{4}× 36\ {g}=108\ {g}$,D正确。]
14. 常温下,二元弱酸$H_3PO_3$溶液中含磷物种的浓度之和为$0.1\ mol·L^{-1}$,溶液中各含磷物种的$pc-pOH$关系如图所示,图中$pc$表示各含磷物种的浓度负对数$(pc=-\lg c)$,$pOH=-\lg c(OH^-)$,下列有关叙述正确的是(
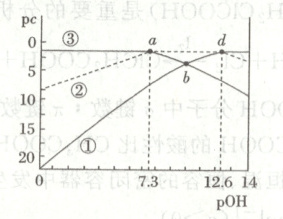
A.曲线③表示$H_3PO_3$
B.$H_3PO_3$的$K_{a1}=10^{-6.7}$
C.$NaH_2PO_3$溶液中:$c(HPO_3^{2-})>c(H_3PO_3)$
D.$b$点:$c(H^+)=c(H_2PO_3^-)+2c(HPO_3^{2-})+c(OH^-)$
C
)
A.曲线③表示$H_3PO_3$
B.$H_3PO_3$的$K_{a1}=10^{-6.7}$
C.$NaH_2PO_3$溶液中:$c(HPO_3^{2-})>c(H_3PO_3)$
D.$b$点:$c(H^+)=c(H_2PO_3^-)+2c(HPO_3^{2-})+c(OH^-)$
答案:
14.C [溶液${pH}$增大、${pOH}$减小,二元弱酸${H_{3}PO_{3}}$溶液中${H_{3}PO_{3}}$的浓度减小,${H_{2}PO^{-}_{3}}$的浓度先增大后减小,${HPO^{2-}_{3}}$的浓度增大,则曲线①表示${H_{3}PO_{3}}$、曲线②表示${H_{2}PO^{-}_{3}}$、曲线③表示${HPO^{2-}_{3}}$;由图可知,溶液中${H_{3}PO_{3}}$和${H_{2}PO^{-}_{3}}$浓度相等时,溶液${pOH}$为$12.6$,则${H_{3}PO_{3}}$的电离常数$K_{a1}=\dfrac{c({H_{2}PO^{-}_{3}})· c({H^{+}})}{c({H_{3}PO_{3}})}=c({H^{+}})=10^{-1.4}$,同理可知,${H_{3}PO_{3}}$的电离常数$K_{a2}=\dfrac{c({HPO^{2-}_{3}})· c({H^{+}})}{c({H_{2}PO^{-}_{3}})}=c({H^{+}})=10^{-6.7}$。曲线③表示${HPO^{2-}_{3}}$,A错误;${H_{3}PO_{3}}$的$K_{a1}=\dfrac{c({H_{2}PO^{-}_{3}})· c({H^{+}})}{c({H_{3}PO_{3}})}=c({H^{+}})=10^{-1.4}$,B错误;由电离常数可知,${H_{2}PO^{-}_{3}}$的水解常数$K_{h}=\dfrac{K_{w}}{K_{a1}}=\dfrac{1.0× 10^{-14}}{1.0× 10^{-1.4}}< K_{a2}=10^{-6.7}$,则${H_{2}PO^{-}_{3}}$在溶液中的电离程度大于水解程度,${NaH_{2}PO_{3}}$溶液中${H_{3}PO_{3}}$的浓度小于${HPO^{2-}_{3}}$的浓度,C正确;由图可知,$b$点为${H_{3}PO_{3}}$和${HPO^{2-}_{3}}$的浓度相等的混合溶液,与${H_{3}PO_{3}}$溶液相比,$b$点溶液加入了碱,由电荷守恒关系可知,$b$点溶液中离子浓度的关系为$c({H^{+}})< c({H_{2}PO^{-}_{3}})+2c({HPO^{2-}_{3}})+c({OH^{-}})$,D错误。]
查看更多完整答案,请扫码查看


