2026年薪火金卷高考仿真模拟卷化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年薪火金卷高考仿真模拟卷化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
6. 用下列实验装置和方法进行相应实验,能达到实验目的的是(
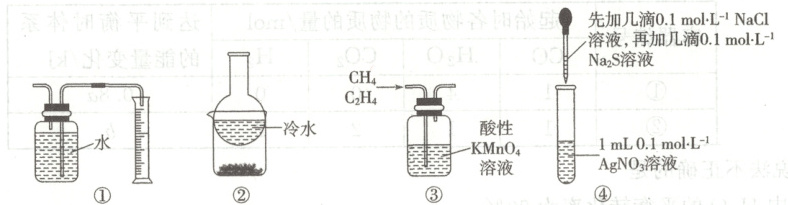
A.可用装置①测量反应产生气体的体积
B.可用装置②分离$NH_4Cl$和$NaCl$
C.可用装置③除去甲烷中混有的乙烯
D.可用装置④证明氯化银溶解度大于硫化银
B
)
A.可用装置①测量反应产生气体的体积
B.可用装置②分离$NH_4Cl$和$NaCl$
C.可用装置③除去甲烷中混有的乙烯
D.可用装置④证明氯化银溶解度大于硫化银
答案:
6.B [用排液体法测量气体体积,伸入量筒的导管尽可能伸入到底部,题中所给装置,伸入量筒的导管太短,A错误;${NH_{4}Cl}$热稳定性较差,受热易分解,遇冷重新生成${NH_{4}Cl}$,${NaCl}$化学性质稳定,沸点较高,因此题中装置可以分离${NH_{4}Cl}$和${NaCl}$,B正确;乙烯被酸性高锰酸钾溶液氧化成二氧化碳,引入新的杂质,题中所给装置不能除去甲烷中混有的乙烯,C错误;向硝酸银溶液滴加几滴${NaCl}$溶液,硝酸银过量,再滴加几滴${Na_{2}S}$溶液,${S^{2-}}$与过量${Ag^{+}}$反应生成${Ag_{2}S}$,即题中不能比较两者溶解度大小,D错误。]
7. 臭氧分解过程如图所示,下列说法正确的是(
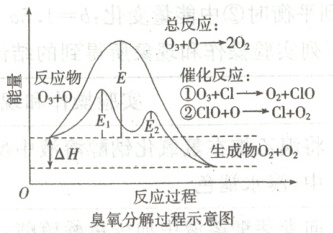
A.催化反应①②均为放热反应
B.决定$O_3$分解反应速率的是催化反应②
C.$E_1$是催化反应①对应的活化能,$(E_2+\Delta H)$是催化反应②对应的逆反应的活化能
D.温度升高,总反应的正反应速率的增加幅度小于逆反应速率的增加幅度,且平衡常数增大
C
)
A.催化反应①②均为放热反应
B.决定$O_3$分解反应速率的是催化反应②
C.$E_1$是催化反应①对应的活化能,$(E_2+\Delta H)$是催化反应②对应的逆反应的活化能
D.温度升高,总反应的正反应速率的增加幅度小于逆反应速率的增加幅度,且平衡常数增大
答案:
7.C [从图上可知,反应①中生成物能量高于反应物,反应①是吸热反应,A错误;决定总反应速率的是慢反应,活化能越大反应越慢,据图可知催化反应①的正反应活化能更大,反应更慢,所以催化反应①决定臭氧的分解速率,B错误;据图可知$E_{1}$为催化反应①中反应物断键吸收的能量,即催化反应①对应的正反应的活化能,$E_{2}+\Delta H$为催化反应②生成物成键时释放的能量,即催化反应②对应的逆反应的活化能,C正确;据图可知总反应的反应物能量高于生成物的能量,所以总反应为放热反应,升高温度,平衡逆向移动,总反应的正反应速率的增加幅度小于逆反应速率的增加幅度,平衡常数减小,D错误。]
8. 向重铬酸盐酸性溶液中加入乙醚和$H_2O_2$,水层发生反应:$Cr_2O_7^{2-}+4H_2O_2+2H^+\xlongequal{}2CrO_5+5H_2O$(已知$CrO_5$的结构为 ,乙醚层发生反应:$CrO_5+(C_2H_5)_2O\xlongequal{}CrO_5·O(C_2H_5)_2$。反应上层出现蓝色,一段时间后溶液蓝色褪去,且水相变为绿色$(Cr^{3+})$,下列说法正确的是(
,乙醚层发生反应:$CrO_5+(C_2H_5)_2O\xlongequal{}CrO_5·O(C_2H_5)_2$。反应上层出现蓝色,一段时间后溶液蓝色褪去,且水相变为绿色$(Cr^{3+})$,下列说法正确的是(
A.由水层反应可知,氧化性:$Cr_2O_7^{2-}>CrO_5$
B.乙醚在检验过程中可用乙醇代替
C.$CrO_5·O(C_2H_5)_2$中不存在非极性键
D.水相变为绿色的离子反应为$4CrO_5+12H^+\xlongequal{}4Cr^{3+}+6H_2O+7O_2\uparrow$
 ,乙醚层发生反应:$CrO_5+(C_2H_5)_2O\xlongequal{}CrO_5·O(C_2H_5)_2$。反应上层出现蓝色,一段时间后溶液蓝色褪去,且水相变为绿色$(Cr^{3+})$,下列说法正确的是(
,乙醚层发生反应:$CrO_5+(C_2H_5)_2O\xlongequal{}CrO_5·O(C_2H_5)_2$。反应上层出现蓝色,一段时间后溶液蓝色褪去,且水相变为绿色$(Cr^{3+})$,下列说法正确的是(D
)A.由水层反应可知,氧化性:$Cr_2O_7^{2-}>CrO_5$
B.乙醚在检验过程中可用乙醇代替
C.$CrO_5·O(C_2H_5)_2$中不存在非极性键
D.水相变为绿色的离子反应为$4CrO_5+12H^+\xlongequal{}4Cr^{3+}+6H_2O+7O_2\uparrow$
答案:
8.D [由水层反应${Cr_{2}O^{2-}_{7} +4H_{2}O_{2} +2H^{+}\xlongequal{}2CrO_{5} +5H_{2}O}$可知,反应前后元素化合价没有发生变化,是非氧化还原反应,A错误;乙醚与${CrO_{5}}$形成配合物并使${CrO_{5}}$进入有机相,在检验过程中作稳定剂和萃取剂,而乙醇易溶于水,故不能用乙醇代替乙醚,B错误;${CrO_{5}· O(C_{2}H_{5})_{2}}$中含${O-O}$、${C-C}$键为非极性键,C错误;水相变为绿色生成了${Cr^{3+}}$,铬元素化合价降低,则氧元素化合价一定升高,应有氧气生成,反应的离子方程式为${4CrO_{5} +12H^{+}\xlongequal{}4Cr^{3+} +6H_{2}O +7O_{2}\uparrow}$,D正确。]
9. $H_2O_2$是常见的绿色氧化剂,在化学研究中应用广泛。用$H_2$制备$H_2O_2$的反应机理如图所示。下列说法不正确的是(
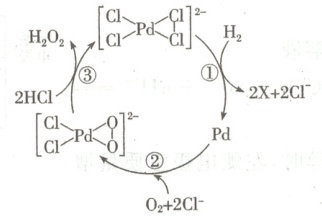
A.$X$代表的是$HCl$
B.过程③有极性键的断裂和形成
C.金属$Pd$在该反应中作催化剂
D.该过程的原子利用率为$100\%$
C
)
A.$X$代表的是$HCl$
B.过程③有极性键的断裂和形成
C.金属$Pd$在该反应中作催化剂
D.该过程的原子利用率为$100\%$
答案:
9.C [根据质量守恒可知,${X}$代表的是${HCl}$,A正确;过程③中${HCl}$参与反应,有极性键的断裂,生成${H_{2}O_{2}}$,有极性键${O-H}$的形成,B正确;经过过程①形成${Pd}$,在过程②中消耗${Pd}$,所以${Pd}$为中间体,C错误;用${H_{2}}$和${O_{2}}$制备${H_{2}O_{2}}$,过程的原子利用率为$100\%$,D正确。]
10. 氯乙酸$(CH_2ClCOOH)$是重要的分析试剂和有机合成中间体。一种制备氯乙酸的方法为$CH_3COOH+Cl_2\xrightarrow{I_2}ClCH_2COOH+HCl$。下列说法正确的是(
A.$CH_3COOH$分子中$\sigma$键数:$\pi$键数$=6:1$
B.$Cl-Cl$比$I-I$的键长更短、键能更小
C.$ClCH_2COOH$的酸性比$CH_3COOH$更强
D.标准状况下,$ClCH_2COOH$是一种液态物质
C
)A.$CH_3COOH$分子中$\sigma$键数:$\pi$键数$=6:1$
B.$Cl-Cl$比$I-I$的键长更短、键能更小
C.$ClCH_2COOH$的酸性比$CH_3COOH$更强
D.标准状况下,$ClCH_2COOH$是一种液态物质
答案:
10.C [共价单键是$\sigma$键,共价双键中有1个$\sigma$键和1个$\pi$键,则${CH_{3}COOH}$分子中$\sigma$键数$:\pi$键数$=7:1$,A错误;原子半径:${Cl < I}$,则${Cl-Cl}$比${I-I}$的键长更短、键能更大,B错误;因电负性:${Cl > H}$,${Cl-C}$的极性大于${H-C}$的极性,使${-CH_{2}Cl}$的极性大于${-CH_{3}}$的极性,导致${ClCH_{2}COOH}$的羧基中的羟基的极性更大,更容易电离出氢离子,则酸性:${ClCH_{2}COOH > CH_{3}COOH}$,C正确;标准状况下,${ClCH_{2}COOH}$是一种固态物质,D错误。]
11. $t\ {^{\circ}C}$时,在恒温、恒容的密闭容器中发生反应:$CO(g)+H_2O(g)⇌CO_2(g)+H_2(g)\ \ \Delta H=-a\ kJ·mol^{-1}(a>0)$
实验数据如下。

下列说法不正确的是(
A.①中$H_2O$的平衡转化率为$20\%$
B.$t\ {^{\circ}C}$时,该反应的平衡常数为1
C.当②中$CO$和$CO_2$浓度相等时,反应达到平衡
D.达到平衡时②中能量变化:$b=1.5a$
实验数据如下。

下列说法不正确的是(
D
)A.①中$H_2O$的平衡转化率为$20\%$
B.$t\ {^{\circ}C}$时,该反应的平衡常数为1
C.当②中$CO$和$CO_2$浓度相等时,反应达到平衡
D.达到平衡时②中能量变化:$b=1.5a$
答案:
11.D [由热化学方程式${CO(g) +H_{2}O(g)⇌ CO_{2}(g) +H_{2}(g)}\ \ \ \Delta H=-a\ {kJ· mol^{-1}}(a > 0)$可知,消耗$1\ {mol}\ {H_{2}O}$时释放$a\ {kJ}$能量,①中平衡时释放$0.8a\ {kJ}$能量,则消耗的${H_{2}O}$的物质的量为$0.8\ {mol}$,因此${H_{2}O}$的平衡转化率为$\dfrac{0.8\ {mol}}{4\ {mol}}× 100\%=20\%$,A正确;列三段式
${CO(g) +H_{2}O(g)⇌ CO_{2}(g) +H_{2}(g)}$
起始/${mol}$ $1$ $4$ $0$ $0$
转化/${mol}$ $0.8$ $0.8$ $0.8$ $0.8$
平衡/${mol}$ $0.2$ $3.2$ $0.8$ $0.8$
设容器容积为$1\ {L}$,$t\ ^{\circ}C$时,该反应的平衡常数$K$为$\dfrac{0.8× 0.8}{0.2× 3.2}=1$,B正确;设当②中${CO}$和${CO_{2}}$浓度相等时,消耗的${CO_{2}}$的物质的量为$x$,三段式
${CO(g) +H_{2}O(g)⇌ CO_{2}(g) +H_{2}(g)}$
起始/${mol}$ $1$ $1$ $2$ $2$
转化/${mol}$ $x$ $x$ $x$ $x$
平衡/${mol}$ $1+x$ $1+x$ $2-x$ $2-x$
则有$1+x=2-x$,解得$x=0.5\ {mol}$,此时容器中各物质的量均为$1.5\ {mol}$,$Q=\dfrac{1.5× 1.5}{1.5× 1.5}=1=K$,即反应达到了平衡状态,C正确;由以上分析可知,达到平衡时②中一氧化碳的物质的量的变化量为$0.5\ {mol}$,当一氧化碳的物质的量的变化量为$1\ {mol}$时,能量变化为$a\ {kJ}$,所以达到平衡时②中能量变化为$b=0.5a$,D错误。]
${CO(g) +H_{2}O(g)⇌ CO_{2}(g) +H_{2}(g)}$
起始/${mol}$ $1$ $4$ $0$ $0$
转化/${mol}$ $0.8$ $0.8$ $0.8$ $0.8$
平衡/${mol}$ $0.2$ $3.2$ $0.8$ $0.8$
设容器容积为$1\ {L}$,$t\ ^{\circ}C$时,该反应的平衡常数$K$为$\dfrac{0.8× 0.8}{0.2× 3.2}=1$,B正确;设当②中${CO}$和${CO_{2}}$浓度相等时,消耗的${CO_{2}}$的物质的量为$x$,三段式
${CO(g) +H_{2}O(g)⇌ CO_{2}(g) +H_{2}(g)}$
起始/${mol}$ $1$ $1$ $2$ $2$
转化/${mol}$ $x$ $x$ $x$ $x$
平衡/${mol}$ $1+x$ $1+x$ $2-x$ $2-x$
则有$1+x=2-x$,解得$x=0.5\ {mol}$,此时容器中各物质的量均为$1.5\ {mol}$,$Q=\dfrac{1.5× 1.5}{1.5× 1.5}=1=K$,即反应达到了平衡状态,C正确;由以上分析可知,达到平衡时②中一氧化碳的物质的量的变化量为$0.5\ {mol}$,当一氧化碳的物质的量的变化量为$1\ {mol}$时,能量变化为$a\ {kJ}$,所以达到平衡时②中能量变化为$b=0.5a$,D错误。]
查看更多完整答案,请扫码查看


