2026年薪火金卷高考仿真模拟卷化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年薪火金卷高考仿真模拟卷化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
8. 2-呋喃甲酸乙酯常用于合成杀虫剂和香料。实验室常由2-呋喃甲酸( )和乙醇在浓硫酸催化下反应制备,其流程如下:
)和乙醇在浓硫酸催化下反应制备,其流程如下:
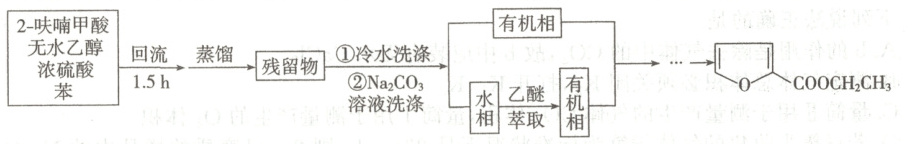
已知:①2-呋喃甲酸乙酯为无色液体,相对于水的密度为$1.117$,沸点为$196\ {^{\circ}C}$;
②2-呋喃甲酸的沸点为$230\ {^{\circ}C}$,乙醇的沸点为$78.4\ {^{\circ}C}$;
③苯与水可形成共沸物,共沸点为$69.25\ {^{\circ}C}$。
下列说法错误的是(
A.反应时添加苯是为了将水及时从体系中移除,提高原料的利用率
B.蒸馏的目的主要是为了除去乙醇
C.洗涤、静置分层后,水相从分液漏斗下层流出后,有机相从上口倒出
D.蒸馏用到的玻璃仪器有酒精灯、蒸馏烧瓶、温度计、直形冷凝管、牛角管、锥形瓶
 )和乙醇在浓硫酸催化下反应制备,其流程如下:
)和乙醇在浓硫酸催化下反应制备,其流程如下:
已知:①2-呋喃甲酸乙酯为无色液体,相对于水的密度为$1.117$,沸点为$196\ {^{\circ}C}$;
②2-呋喃甲酸的沸点为$230\ {^{\circ}C}$,乙醇的沸点为$78.4\ {^{\circ}C}$;
③苯与水可形成共沸物,共沸点为$69.25\ {^{\circ}C}$。
下列说法错误的是(
C
)A.反应时添加苯是为了将水及时从体系中移除,提高原料的利用率
B.蒸馏的目的主要是为了除去乙醇
C.洗涤、静置分层后,水相从分液漏斗下层流出后,有机相从上口倒出
D.蒸馏用到的玻璃仪器有酒精灯、蒸馏烧瓶、温度计、直形冷凝管、牛角管、锥形瓶
答案:
8.C [由于制备2 - 呋喃甲酸乙酯的反应是酯化反应,是可逆反应,苯与水形成共沸物,从体系中将水移除,使平衡向正反应方向移动,可提高原料的利用率,A正确;乙醇的沸点为$78.4^{\circ}C$,蒸馏的目的主要是为了除去乙醇,B正确;2 - 呋喃甲酸乙酯相对于水的密度为1.117,有机物密度比水大,则洗涤,静置分层后,将有机相从下层流出后,水相再从上口倒出,C错误;蒸馏用到的玻璃仪器有酒精灯、蒸馏烧瓶、温度计、直形冷凝管、牛角管、锥形瓶,D正确。]
9. 现代有机合成为药物制备做出了巨大贡献。某药物制备路线中的一步反应如图所示(部分产物未给出)。下列说法错误的是(
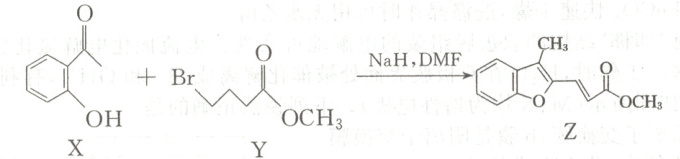
A.${Z}$中无手性碳原子,与足量氢气加成所得分子中含有4个手性碳原子
B.$1\ {mol}\ {Y}$与${NaOH}$溶液反应,最多消耗$1\ {mol}\ {NaOH}$
C.$1\ {mol}\ {Z}$最多能与$5\ {mol}\ {H_{2}}$发生加成反应
D.${X}$、${Y}$、${Z}$中所有碳原子均可能在同一平面内
B
)
A.${Z}$中无手性碳原子,与足量氢气加成所得分子中含有4个手性碳原子
B.$1\ {mol}\ {Y}$与${NaOH}$溶液反应,最多消耗$1\ {mol}\ {NaOH}$
C.$1\ {mol}\ {Z}$最多能与$5\ {mol}\ {H_{2}}$发生加成反应
D.${X}$、${Y}$、${Z}$中所有碳原子均可能在同一平面内
答案:
9.B [Z中无手性碳原子,与足量$H_{2}$加成后,苯环和五元环变为饱和环,侧链双键变为单键,生成的饱和环上多个碳原子连有不同基团,形成4个手性碳 ,A正确;Y为$BrCH_{2}CH_{2}CH_{2}COOCH_{3}$,1 mol Y与NaOH溶液反应时,酯基水解消耗1 mol NaOH,卤代烃水解消耗1 mol NaOH,最多消耗2 mol NaOH,B错误;Z中含1个苯环($3\ mol\ H_{2}$)、1个五元环双键($1\ mol\ H_{2}$)、1个侧链碳碳双键($1\ mol\ H_{2}$),共消耗5 mol $H_{2}$,C正确;苯环是平面结构,碳碳双键是平面结构,与苯环相连的碳原子可以和苯环处于同一平面,酯基也是平面结构,烷烃分子中,碳原子经过适当的旋转,碳原子也可以处于同一平面内,故X、Y、Z中所有碳原子均可能在同一平面内,D正确。]
,A正确;Y为$BrCH_{2}CH_{2}CH_{2}COOCH_{3}$,1 mol Y与NaOH溶液反应时,酯基水解消耗1 mol NaOH,卤代烃水解消耗1 mol NaOH,最多消耗2 mol NaOH,B错误;Z中含1个苯环($3\ mol\ H_{2}$)、1个五元环双键($1\ mol\ H_{2}$)、1个侧链碳碳双键($1\ mol\ H_{2}$),共消耗5 mol $H_{2}$,C正确;苯环是平面结构,碳碳双键是平面结构,与苯环相连的碳原子可以和苯环处于同一平面,酯基也是平面结构,烷烃分子中,碳原子经过适当的旋转,碳原子也可以处于同一平面内,故X、Y、Z中所有碳原子均可能在同一平面内,D正确。]
9.B [Z中无手性碳原子,与足量$H_{2}$加成后,苯环和五元环变为饱和环,侧链双键变为单键,生成的饱和环上多个碳原子连有不同基团,形成4个手性碳
 ,A正确;Y为$BrCH_{2}CH_{2}CH_{2}COOCH_{3}$,1 mol Y与NaOH溶液反应时,酯基水解消耗1 mol NaOH,卤代烃水解消耗1 mol NaOH,最多消耗2 mol NaOH,B错误;Z中含1个苯环($3\ mol\ H_{2}$)、1个五元环双键($1\ mol\ H_{2}$)、1个侧链碳碳双键($1\ mol\ H_{2}$),共消耗5 mol $H_{2}$,C正确;苯环是平面结构,碳碳双键是平面结构,与苯环相连的碳原子可以和苯环处于同一平面,酯基也是平面结构,烷烃分子中,碳原子经过适当的旋转,碳原子也可以处于同一平面内,故X、Y、Z中所有碳原子均可能在同一平面内,D正确。]
,A正确;Y为$BrCH_{2}CH_{2}CH_{2}COOCH_{3}$,1 mol Y与NaOH溶液反应时,酯基水解消耗1 mol NaOH,卤代烃水解消耗1 mol NaOH,最多消耗2 mol NaOH,B错误;Z中含1个苯环($3\ mol\ H_{2}$)、1个五元环双键($1\ mol\ H_{2}$)、1个侧链碳碳双键($1\ mol\ H_{2}$),共消耗5 mol $H_{2}$,C正确;苯环是平面结构,碳碳双键是平面结构,与苯环相连的碳原子可以和苯环处于同一平面,酯基也是平面结构,烷烃分子中,碳原子经过适当的旋转,碳原子也可以处于同一平面内,故X、Y、Z中所有碳原子均可能在同一平面内,D正确。] 10. 从废弃的声光器件(${TeO_{2}}$,含${Al}$、${Cu}$、${SiO_{2}}$杂质)中提取粗碲的工艺流程如图,已知${TeO_{2}}$性质与${SO_{2}}$相似,氧化沉碲得${Na_{2}TeO_{4}}$,下列说法错误的是(
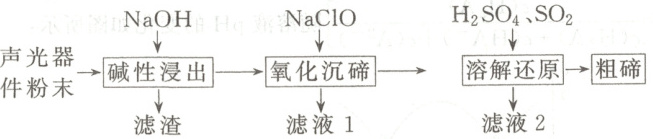
A.滤渣的主要成分为${Cu}$
B.滤液1和滤液2混合可能产生白色沉淀
C.“氧化沉碲”中离子方程式为${TeO^{2-}_{3} + ClO^{-}\xlongequal{}TeO^{2-}_{4} + Cl^{-}}$
D.“溶解还原”中氧化剂和还原剂的物质的量之比为$1:3$
C
)
A.滤渣的主要成分为${Cu}$
B.滤液1和滤液2混合可能产生白色沉淀
C.“氧化沉碲”中离子方程式为${TeO^{2-}_{3} + ClO^{-}\xlongequal{}TeO^{2-}_{4} + Cl^{-}}$
D.“溶解还原”中氧化剂和还原剂的物质的量之比为$1:3$
答案:
10.C [Cu不溶于NaOH溶液,滤渣的主要成分为Cu,A正确;滤液1主要含有$Na[Al(OH)_{4}]$、$Na_{2}SiO_{3}$和NaCl,滤液2主要含$H_{2}SO_{4}$、$Na_{2}SO_{4}$,则滤液1和滤液2混合时因$[Al(OH)_{4}]^{-}$、$H^{+}$和$H_{2}O$反应可能产生白色的$Al(OH)_{3}$沉淀,B正确;“氧化沉碲”时,$Na_{2}TeO_{3}$被氧化生成$Na_{2}TeO_{4}$沉淀,NaClO被还原生成NaCl,反应的离子方程式为$2Na^{+} + TeO^{2 - }_{3} + ClO^{-} = Na_{2}TeO_{4}\downarrow + Cl^{-}$,C错误;“溶解还原”时,$Na_{2}TeO_{4}$被还原生成Te,$SO_{2}$被氧化为$SO^{2 - }_{4}$,根据得失电子守恒可得关系式:$Na_{2}TeO_{4} \sim 3SO_{2}$,$Na_{2}TeO_{4}$作氧化剂,$SO_{2}$作还原剂,则氧化剂和还原剂的物质的量之比为1:3,D正确。]
查看更多完整答案,请扫码查看


