2026年薪火金卷高考仿真模拟卷化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年薪火金卷高考仿真模拟卷化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
15. (16分)2023年8月1日起,中国对镓、锗相关物项进行出口管制。金属镓有“电子工业脊梁”的美誉,与铝的化学性质类似,广泛应用于电子、航空航天、光学等领域。从刚玉渣(含钛、镓的低硅铁合金,还含有少量氧化铝)回收镓的流程如图所示:
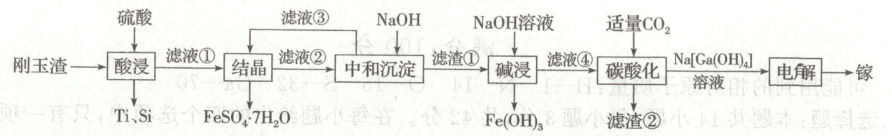
室温时,溶液中金属离子开始沉淀和完全沉淀的 {pH} 如下表所示:

请回答下列问题:
(1)基态镓原子的价电子排布式为 。
(2)从溶液中得到$ {FeSO_{4} · 7H_{2}O} $的具体操作为
(3)“中和沉淀”过程中分离出的滤渣①有$ {Fe(OH)_{3}} $和
(4)“碱浸”时镓元素发生的离子方程式为
(5)“碳酸化”过程中为防止镓损耗,不能通入过量$ {CO_{2}} $的原因
(6)以纯镓为原料可制得 {GaN} , {GaN} 晶体的一种立方晶胞如图所示, {Ga} 的配位数为


室温时,溶液中金属离子开始沉淀和完全沉淀的 {pH} 如下表所示:

请回答下列问题:
(1)基态镓原子的价电子排布式为 。
$4s^{2}4p^{1}$
(2)从溶液中得到$ {FeSO_{4} · 7H_{2}O} $的具体操作为
蒸发浓缩
、冷却结晶
、过滤、洗涤、干燥。(3)“中和沉淀”过程中分离出的滤渣①有$ {Fe(OH)_{3}} $和
$Al(OH)_{3}$、$Ga(OH)_{3}$
(填化学式),若滤液②中阳离子浓度均为$ 0.1\ mol · L^{-1} ,“$中和沉淀”过程中 {pH} 应调节的范围为$5.5\leqslant pH < 7$
。(4)“碱浸”时镓元素发生的离子方程式为
$Ga(OH)_{3}+OH^{-}=[Ga(OH)_{4}]^{-}$
。(5)“碳酸化”过程中为防止镓损耗,不能通入过量$ {CO_{2}} $的原因
$[Ga(OH)_{4}]^{-}+CO_{2}=Ga(OH)_{3}\downarrow+HCO_{3}^{-}$
(用离子方程式表示)。(6)以纯镓为原料可制得 {GaN} , {GaN} 晶体的一种立方晶胞如图所示, {Ga} 的配位数为
4
,已知晶胞中 {Ga} 和 {N} 的最近距离为 a\ nm ,阿伏加德罗常数为$ N_{A} ,$则 {GaN} 的晶体密度为$\frac{4×84}{N_{A}×(\frac{4\sqrt{3}}{3}a)^{3}}×10^{21}$
$ g · cm^{-3} ($列出计算式)。
答案:
15.解析 刚玉渣加入稀硫酸酸化,滤渣中含有Ti和Si单质,滤液中含有$Ga^{3 + }$、$Al^{3 + }$、$Fe^{2 + }$、$Fe^{3 + }$,通过蒸发浓缩、冷却结晶、过滤、洗涤、干燥得到$FeSO_{4}· 7H_{2}O$晶体,滤液中含有$Ga^{3 + }$、$Al^{3 + }$、$Fe^{3 + }$,加入NaOH调节为5.5 ~ 7.5,“中和沉淀”得到$Fe(OH)_{3}$、$Al(OH)_{3}$、$Ga(OH)_{3}$,再加入过量的NaOH,$Al(OH)_{3}$、$Ga(OH)_{3}$溶解,分别生成$[Al(OH)_{4}]^{-}$和$[Ga(OH)_{4}]^{-}$,除去$Fe(OH)_{3}$,向滤液中通入适量的$CO_{2}$,$[Al(OH)_{4}]^{-}$生成$Al(OH)_{3}$,$[Ga(OH)_{4}]^{-}$不发生反应,电解含有$[Ga(OH)_{4}]^{-}$的溶液得到Ga单质。
(1)镓为31号元素,基态镓原子的价电子排布式为$4s^{2}4p^{1}$。
(2)从溶液中得到$FeSO_{4}· 7H_{2}O$的具体操作为蒸发浓缩、冷却结晶、过滤、洗涤、干燥。
(3)由分析可知,“中和沉淀”过程中分离出的滤渣①有$Fe(OH)_{3}$和$Al(OH)_{3}$、$Ga(OH)_{3}$,若滤液②中阳离子浓度均为$0.1mol· L^{- 1}$,“中和沉淀”过程中镓离子要完全沉淀,而亚铁离子不沉淀,由表格数据可知,$pH = 9.0$时亚铁离子完全沉淀,此时$pOH = 5$,$K_{sp}[Fe(OH)_{2}]=c(Fe^{2 + })· c^{2}(OH^{-})=1.0×10^{- 5}×(1.0×10^{- 5})^{2}=1.0×10^{- 15}$,滤液②中阳离子浓度均为$0.1mol· L^{- 1}$,则需控制$c(OH^{-})=\sqrt{\frac{1.0×10^{- 15}}{0.1}}mol· L^{- 1}=1.0×10^{- 7}mol· L^{- 1}$,$pOH = 7$,$pH = 7$,故pH应调节的范围为$5.5\leqslant pH < 7$。
(4)“碱浸”时$Ga(OH)_{3}$溶解生成$[Ga(OH)_{4}]^{-}$,发生的离子方程式为$Ga(OH)_{3}+OH^{-}=[Ga(OH)_{4}]^{-}$。
(5)“碳酸化”过程中为防止镓损耗,不能通入过量$CO_{2}$,过量的二氧化碳会导致$[Ga(OH)_{4}]^{-}$转化为氢氧化镓沉淀,反应为$[Ga(OH)_{4}]^{-}+CO_{2}=Ga(OH)_{3}\downarrow+HCO_{3}^{-}$。
(6)由图可知,氮位于镓形成的四面体中,结合化学式可知,镓位于氮形成的四面体中,故Ga的配位数为4;已知晶胞中Ga和N的最近距离为a nm,其距离为体对角线的四分之一,则晶胞参数为$\frac{4\sqrt{3}}{3}a$ nm,根据“均摊法”,晶胞中含$8×\frac{1}{8}+6×\frac{1}{2}=4$个Ga、4个N,则晶体密度为$\frac{\frac{4M}{N_{A}}}{(\frac{4\sqrt{3}}{3}a)^{3}}×10^{21}g· cm^{- 3}=\frac{4×84}{N_{A}×(\frac{4\sqrt{3}}{3}a)^{3}}×10^{21}g· cm^{- 3}$。
答案
(1)$4s^{2}4p^{1}$
(2)蒸发浓缩 冷却结晶
(3)$Al(OH)_{3}$、$Ga(OH)_{3}$ $5.5\leqslant pH < 7$
(4)$Ga(OH)_{3}+OH^{-}=[Ga(OH)_{4}]^{-}$
(5)$[Ga(OH)_{4}]^{-}+CO_{2}=Ga(OH)_{3}\downarrow+HCO_{3}^{-}$
(6)4 $\frac{4×84}{N_{A}×(\frac{4\sqrt{3}}{3}a)^{3}}×10^{21}$
(1)镓为31号元素,基态镓原子的价电子排布式为$4s^{2}4p^{1}$。
(2)从溶液中得到$FeSO_{4}· 7H_{2}O$的具体操作为蒸发浓缩、冷却结晶、过滤、洗涤、干燥。
(3)由分析可知,“中和沉淀”过程中分离出的滤渣①有$Fe(OH)_{3}$和$Al(OH)_{3}$、$Ga(OH)_{3}$,若滤液②中阳离子浓度均为$0.1mol· L^{- 1}$,“中和沉淀”过程中镓离子要完全沉淀,而亚铁离子不沉淀,由表格数据可知,$pH = 9.0$时亚铁离子完全沉淀,此时$pOH = 5$,$K_{sp}[Fe(OH)_{2}]=c(Fe^{2 + })· c^{2}(OH^{-})=1.0×10^{- 5}×(1.0×10^{- 5})^{2}=1.0×10^{- 15}$,滤液②中阳离子浓度均为$0.1mol· L^{- 1}$,则需控制$c(OH^{-})=\sqrt{\frac{1.0×10^{- 15}}{0.1}}mol· L^{- 1}=1.0×10^{- 7}mol· L^{- 1}$,$pOH = 7$,$pH = 7$,故pH应调节的范围为$5.5\leqslant pH < 7$。
(4)“碱浸”时$Ga(OH)_{3}$溶解生成$[Ga(OH)_{4}]^{-}$,发生的离子方程式为$Ga(OH)_{3}+OH^{-}=[Ga(OH)_{4}]^{-}$。
(5)“碳酸化”过程中为防止镓损耗,不能通入过量$CO_{2}$,过量的二氧化碳会导致$[Ga(OH)_{4}]^{-}$转化为氢氧化镓沉淀,反应为$[Ga(OH)_{4}]^{-}+CO_{2}=Ga(OH)_{3}\downarrow+HCO_{3}^{-}$。
(6)由图可知,氮位于镓形成的四面体中,结合化学式可知,镓位于氮形成的四面体中,故Ga的配位数为4;已知晶胞中Ga和N的最近距离为a nm,其距离为体对角线的四分之一,则晶胞参数为$\frac{4\sqrt{3}}{3}a$ nm,根据“均摊法”,晶胞中含$8×\frac{1}{8}+6×\frac{1}{2}=4$个Ga、4个N,则晶体密度为$\frac{\frac{4M}{N_{A}}}{(\frac{4\sqrt{3}}{3}a)^{3}}×10^{21}g· cm^{- 3}=\frac{4×84}{N_{A}×(\frac{4\sqrt{3}}{3}a)^{3}}×10^{21}g· cm^{- 3}$。
答案
(1)$4s^{2}4p^{1}$
(2)蒸发浓缩 冷却结晶
(3)$Al(OH)_{3}$、$Ga(OH)_{3}$ $5.5\leqslant pH < 7$
(4)$Ga(OH)_{3}+OH^{-}=[Ga(OH)_{4}]^{-}$
(5)$[Ga(OH)_{4}]^{-}+CO_{2}=Ga(OH)_{3}\downarrow+HCO_{3}^{-}$
(6)4 $\frac{4×84}{N_{A}×(\frac{4\sqrt{3}}{3}a)^{3}}×10^{21}$
16. (14分)深入研究含碳、氮元素物质的转化有着重要的实际意义。回答下列问题:
Ⅰ. 合成尿素:如图所示是合成尿素反应的机理及能量变化(单位$: kJ · mol^{-1} ), TS $表示过渡态。
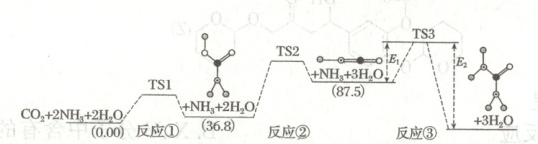
(1)若$ E_{1} = 66.5\ kJ · mol^{-1} , E_{2} = 241.0\ kJ · mol^{-1} ,$则总反应$ 2{NH_{3}(g) + CO_{2}(g) \rightleftharpoons CO(NH_{2})_{2}(g) + H_{2}O(g)} \Delta H = kJ · mol^{-1}$
(2)若向某恒温恒容的密闭容器中加入等物质的量的$ {NH_{3}} $和$ {CO_{2}} $发生上述反应。结合以上机理,下列叙述不能说明反应已经达到平衡状态的是
$a. {CO_{2}} $的体积分数不再变化
b. 气体质量不再变化
$c. 2v_{正}({NH_{3}}) = v_{逆}({CO_{2}}) $
d. 体系中气体密度不变
e. 断裂 2\ mol {C = O} 的同时断裂 2\ mol {O—H}
(3)图为使用不同催化剂①、②、③时,反应至相同时间,容器中尿素的物质的量随温度变化的曲线, A 点
Ⅱ. {CO} 处理大气污染物$ {N_{2}O} $
$(4)① {N_{2}O} 、$ {CO} 在催化剂$ {Pt_{2}O^{+}} $的表面进行两步反应转化为无毒的气体,第一步为$ {N_{2}O + Pt_{2}O^{+} \rightleftharpoons N_{2} + Pt_{2}O^{+}_{2}} ;$则第二步为
②已知$: {CO(g) + N_{2}O(g) \rightleftharpoons CO_{2}(g) + N_{2}(g)} $的速率方程为$ v = k · c({N_{2}O}) , k $为速率常数,只与温度有关。为提高反应速率,可采取的措施是
A. 升温
B. 恒容时,再充入$ {N_{2}O} $
C. 恒容时,再充入 {CO}
D. 恒压时,再充入$ {N_{2}O} $
(5)在总压为 80\ kPa 的恒容密闭容器中,充入一定量的 {CO(g)} 和$ {N_{2}O(g)} $发生上述反应,在不同条件下达到平衡时,温度$ T_{1}\ K $时$ {N_{2}O} $的转化率随$ \dfrac{n({N_{2}O})}{n({CO})} $变化的曲线,以及在$ \dfrac{n({N_{2}O})}{n({CO})} = 1 $时$ {N_{2}O} $的转化率随$ \dfrac{1}{T} $变化的曲线如图所示:

①表示$ {N_{2}O} $的转化率随$ \dfrac{n({N_{2}O})}{n({CO})} $变化的曲线为曲线
②在$ T_{1}\ K $时,用平衡分压代替其平衡浓度表示的化学平衡常数$ K_{p} =$

Ⅰ. 合成尿素:如图所示是合成尿素反应的机理及能量变化(单位$: kJ · mol^{-1} ), TS $表示过渡态。

(1)若$ E_{1} = 66.5\ kJ · mol^{-1} , E_{2} = 241.0\ kJ · mol^{-1} ,$则总反应$ 2{NH_{3}(g) + CO_{2}(g) \rightleftharpoons CO(NH_{2})_{2}(g) + H_{2}O(g)} \Delta H = kJ · mol^{-1}$
$-87$
$。$(2)若向某恒温恒容的密闭容器中加入等物质的量的$ {NH_{3}} $和$ {CO_{2}} $发生上述反应。结合以上机理,下列叙述不能说明反应已经达到平衡状态的是
bcd
(填字母)。$a. {CO_{2}} $的体积分数不再变化
b. 气体质量不再变化
$c. 2v_{正}({NH_{3}}) = v_{逆}({CO_{2}}) $
d. 体系中气体密度不变
e. 断裂 2\ mol {C = O} 的同时断裂 2\ mol {O—H}
(3)图为使用不同催化剂①、②、③时,反应至相同时间,容器中尿素的物质的量随温度变化的曲线, A 点
不是
(填“是”或“不是”)平衡状态$, T_{2}^{\circ}C $以上$ n[{CO(NH_{2})_{2}}] $下降的原因可能是随着温度升高,可能是催化剂活性降低(或失去活性),反应速率降低,单位时间内生成尿素的物质的量减少
(答出一点即可,不考虑物质的稳定性)。Ⅱ. {CO} 处理大气污染物$ {N_{2}O} $
$(4)① {N_{2}O} 、$ {CO} 在催化剂$ {Pt_{2}O^{+}} $的表面进行两步反应转化为无毒的气体,第一步为$ {N_{2}O + Pt_{2}O^{+} \rightleftharpoons N_{2} + Pt_{2}O^{+}_{2}} ;$则第二步为
$CO + Pt_{2}O_{2}^{+}\rightleftharpoons CO_{2}+Pt_{2}O^{+}$
。②已知$: {CO(g) + N_{2}O(g) \rightleftharpoons CO_{2}(g) + N_{2}(g)} $的速率方程为$ v = k · c({N_{2}O}) , k $为速率常数,只与温度有关。为提高反应速率,可采取的措施是
AB
(填字母)。A. 升温
B. 恒容时,再充入$ {N_{2}O} $
C. 恒容时,再充入 {CO}
D. 恒压时,再充入$ {N_{2}O} $
(5)在总压为 80\ kPa 的恒容密闭容器中,充入一定量的 {CO(g)} 和$ {N_{2}O(g)} $发生上述反应,在不同条件下达到平衡时,温度$ T_{1}\ K $时$ {N_{2}O} $的转化率随$ \dfrac{n({N_{2}O})}{n({CO})} $变化的曲线,以及在$ \dfrac{n({N_{2}O})}{n({CO})} = 1 $时$ {N_{2}O} $的转化率随$ \dfrac{1}{T} $变化的曲线如图所示:

①表示$ {N_{2}O} $的转化率随$ \dfrac{n({N_{2}O})}{n({CO})} $变化的曲线为曲线
Ⅱ
(填“Ⅰ”或“Ⅱ”);上述反应为放热反应
(“放热反应”或“吸热反应”)。②在$ T_{1}\ K $时,用平衡分压代替其平衡浓度表示的化学平衡常数$ K_{p} =$
3.45
$ ($结果保留两位小数)[已知:气体分压$ (p_{分}) = $气体总压$ (p_{总}) × $该气体的物质的量分数]。
答案:
16.解析
(1)由图可知,总反应的焓变为$E_{1}+87.5 - E_{2}=(66.5 + 87.5 + 241.0)kJ· mol^{- 1}=- 87kJ· mol^{- 1}$。
(2)a.$CO_{2}$的体积分数不再变化,说明平衡不再移动,正、逆反应速率相等,达到平衡状态,不符合题意;b.根据质量守恒得知气体质量是定值,其不变不能说明达到平衡状态,符合题意;c.反应速率比等于系数比,若$2v_{正}(NH_{3}) = v_{逆}(CO_{2})$,则正、逆反应速率不相等,没有达到平衡状态,符合题意;d.气体质量和体积为定值,因此气体密度为定值,其不变不能说明达到平衡状态,符合题意;e.断裂$2molC = O$的同时断裂$2molO - H$,正、逆反应速率相等,达到平衡状态,不符合题意;故选bcd。
(3)A点尿素的量低于③催化剂时的量,则说明没有达到平衡状态;催化剂需要一定的活化温度,随着温度升高,可能是催化剂活性降低(或失去活性),反应速率降低,导致单位时间内生成尿素的物质的量减少,使得$T_{2}^{\circ}C$以上$n[CO(NH_{2})_{2}]$下降。
(4)①$N_{2}O$、CO在催化剂$Pt_{2}O^{+}$的表面进行两步反应转化为无毒的气体,结合质量守恒可知,生成气体为氮气和二氧化碳,总反应为$N_{2}O + CO\rightleftharpoons N_{2}+CO_{2}$,第一步为$N_{2}O + Pt_{2}O^{+}\rightleftharpoons N_{2}+Pt_{2}O_{2}^{+}$,则第二步为$CO + Pt_{2}O_{2}^{+}\rightleftharpoons CO_{2}+Pt_{2}O^{+}$;②A.升温,速率常数变大,反应速率加快,正确;B.由速率常数可知,恒容时,再充入$N_{2}O$,其浓度变大,反应速率变大,正确;C.由速率常数可知,恒容时,再充入CO,不影响反应速率,错误;D.由速率常数可知,恒压时,再充入$N_{2}O$,不影响反应速率,错误;故选AB。
(5)①由化学平衡移动原理可知,$\frac{n(N_{2}O)}{n(CO)}$的值越大,一氧化二氮自身的转化率越小,所以曲线Ⅱ表示一氧化二氮的转化率随$\frac{n(N_{2}O)}{n(CO)}$的变化,则曲线Ⅰ为$\frac{n(N_{2}O)}{n(CO)} = 1$时$N_{2}O$的转化率随$\frac{1}{T}$变化的曲线,由图可知,降低温度,$N_{2}O$转化率增大,平衡正向移动,则正反应为放热反应,焓变小于0;②该反应是气体体积不变的反应,平衡前后气体的总压强不变,在总压为80kPa的$\frac{n(N_{2}O)}{n(CO)} = 1$的容器中,一氧化二氮和一氧化碳的起始分压都为40kPa,由图可知,温度为$T_{1}$时,一氧化二氮的转化率为65%,由方程式可知,平衡时,一氧化二氮和一氧化碳的分压都为$40kPa - 40kPa×65\% = 14kPa$,二氧化碳和氮气的分压都为$40kPa×65\% = 26kPa$,则用平衡分压代替其平衡浓度表示的化学平衡常数为$K_{p}=\frac{26kPa×26kPa}{14kPa×14kPa}\approx3.45$。
答案
(1)$- 87$
(2)bcd
(3)不是 随着温度升高,可能是催化剂活性降低(或失去活性),反应速率降低,单位时间内生成尿素的物质的量减少
(4)①$CO + Pt_{2}O_{2}^{+}\rightleftharpoons CO_{2}+Pt_{2}O^{+}$ ②AB
(5)①Ⅱ 放热反应 ②3.45
(1)由图可知,总反应的焓变为$E_{1}+87.5 - E_{2}=(66.5 + 87.5 + 241.0)kJ· mol^{- 1}=- 87kJ· mol^{- 1}$。
(2)a.$CO_{2}$的体积分数不再变化,说明平衡不再移动,正、逆反应速率相等,达到平衡状态,不符合题意;b.根据质量守恒得知气体质量是定值,其不变不能说明达到平衡状态,符合题意;c.反应速率比等于系数比,若$2v_{正}(NH_{3}) = v_{逆}(CO_{2})$,则正、逆反应速率不相等,没有达到平衡状态,符合题意;d.气体质量和体积为定值,因此气体密度为定值,其不变不能说明达到平衡状态,符合题意;e.断裂$2molC = O$的同时断裂$2molO - H$,正、逆反应速率相等,达到平衡状态,不符合题意;故选bcd。
(3)A点尿素的量低于③催化剂时的量,则说明没有达到平衡状态;催化剂需要一定的活化温度,随着温度升高,可能是催化剂活性降低(或失去活性),反应速率降低,导致单位时间内生成尿素的物质的量减少,使得$T_{2}^{\circ}C$以上$n[CO(NH_{2})_{2}]$下降。
(4)①$N_{2}O$、CO在催化剂$Pt_{2}O^{+}$的表面进行两步反应转化为无毒的气体,结合质量守恒可知,生成气体为氮气和二氧化碳,总反应为$N_{2}O + CO\rightleftharpoons N_{2}+CO_{2}$,第一步为$N_{2}O + Pt_{2}O^{+}\rightleftharpoons N_{2}+Pt_{2}O_{2}^{+}$,则第二步为$CO + Pt_{2}O_{2}^{+}\rightleftharpoons CO_{2}+Pt_{2}O^{+}$;②A.升温,速率常数变大,反应速率加快,正确;B.由速率常数可知,恒容时,再充入$N_{2}O$,其浓度变大,反应速率变大,正确;C.由速率常数可知,恒容时,再充入CO,不影响反应速率,错误;D.由速率常数可知,恒压时,再充入$N_{2}O$,不影响反应速率,错误;故选AB。
(5)①由化学平衡移动原理可知,$\frac{n(N_{2}O)}{n(CO)}$的值越大,一氧化二氮自身的转化率越小,所以曲线Ⅱ表示一氧化二氮的转化率随$\frac{n(N_{2}O)}{n(CO)}$的变化,则曲线Ⅰ为$\frac{n(N_{2}O)}{n(CO)} = 1$时$N_{2}O$的转化率随$\frac{1}{T}$变化的曲线,由图可知,降低温度,$N_{2}O$转化率增大,平衡正向移动,则正反应为放热反应,焓变小于0;②该反应是气体体积不变的反应,平衡前后气体的总压强不变,在总压为80kPa的$\frac{n(N_{2}O)}{n(CO)} = 1$的容器中,一氧化二氮和一氧化碳的起始分压都为40kPa,由图可知,温度为$T_{1}$时,一氧化二氮的转化率为65%,由方程式可知,平衡时,一氧化二氮和一氧化碳的分压都为$40kPa - 40kPa×65\% = 14kPa$,二氧化碳和氮气的分压都为$40kPa×65\% = 26kPa$,则用平衡分压代替其平衡浓度表示的化学平衡常数为$K_{p}=\frac{26kPa×26kPa}{14kPa×14kPa}\approx3.45$。
答案
(1)$- 87$
(2)bcd
(3)不是 随着温度升高,可能是催化剂活性降低(或失去活性),反应速率降低,单位时间内生成尿素的物质的量减少
(4)①$CO + Pt_{2}O_{2}^{+}\rightleftharpoons CO_{2}+Pt_{2}O^{+}$ ②AB
(5)①Ⅱ 放热反应 ②3.45
查看更多完整答案,请扫码查看


