2026年薪火金卷高考仿真模拟卷化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年薪火金卷高考仿真模拟卷化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
15. (16分)锗广泛应用于现代高新技术产业。某科研小组用氧化锌烟尘(主要成分为$ZnO$,含有$ZnFe_2O_4$、$PbO$、$GeO_2$、$GeS_2$、$SiO_2$及少量$As$的化合物等)制取锗并回收锌的一种流程如下:
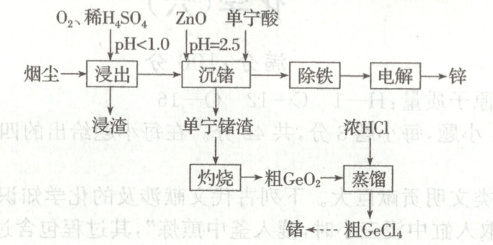
请回答下列问题:
(1)浸渣的主要成分有$S$、$PbSO_4$和
(2)单宁酸$(H_2L)$“沉锗”时主要发生反应$Ge^{4+}+3H_2L⇌H_2GeL_3+4H^+$,最佳$pH=2.5$,$pH$过低会导致
(3)“蒸馏”得到的粗$GeCl_4$中混有少量$AsCl_3$杂质,二者均为分子晶体,$AsCl_3$的空间结构为
(4)碱浸“电解”法可生产出高质量的锌粉:先加入浓$NaOH$溶液将$Zn^{2+}$转化为$Zn(OH)_4^{2-}$,再电解得到锌,$[Zn(OH)_4]^{2-}$中与$Zn^{2+}$配位的原子是

请回答下列问题:
(1)浸渣的主要成分有$S$、$PbSO_4$和
SiO2
(填化学式);“浸出”后,锗元素以$Ge^{4+}$形式存在于溶液中,写出“浸出”时$GeS_2$所发生反应的离子方程式: 。GeS2 +4H+ +O2 = Ge4+ +2S +2H2O
(2)单宁酸$(H_2L)$“沉锗”时主要发生反应$Ge^{4+}+3H_2L⇌H_2GeL_3+4H^+$,最佳$pH=2.5$,$pH$过低会导致
沉锗平衡逆向移动
,使沉锗率下降;为提高沉锗速率,可采取的措施有适当加热(或增大单宁酸的浓度、搅拌,合理即可)
(写一种即可)。(3)“蒸馏”得到的粗$GeCl_4$中混有少量$AsCl_3$杂质,二者均为分子晶体,$AsCl_3$的空间结构为
三角锥形
,其沸点高于$GeCl_4$,原因是AsCl3为极性分子,分子间作用力比GeCl4大,所以AsCl3沸点比GeCl4高
(相对分子质量$GeCl_4$:214.6,$AsCl_3$:181.4)。(4)碱浸“电解”法可生产出高质量的锌粉:先加入浓$NaOH$溶液将$Zn^{2+}$转化为$Zn(OH)_4^{2-}$,再电解得到锌,$[Zn(OH)_4]^{2-}$中与$Zn^{2+}$配位的原子是
O
,写出电解析出锌的电极反应[Zn(OH)4]2- +2e- = Zn +4OH-
。
答案:
15.解析 由题给流程可知,烟尘用稀硫酸和氧气浸出时,金属元素转化为硫酸盐、硫元素转化为单质硫,砷元素转化为可溶化合物,二氧化硅不反应,过滤得到含有硫酸铅、硫、二氧化硅的浸渣;向滤液中加入氧化锌、单宁酸,在溶液${pH}\ 2.5$的条件下将锗元素转化为沉淀,过滤得到单宁锗渣和滤液;滤液除铁后得到含有锌离子的溶液,向溶液中加入浓氢氧化钠溶液,将溶液中锌离子转化为四羟基合锌离子,电解反应得到的溶液,在阴极得到锌;单宁锗渣灼烧得到粗二氧化锗,粗二氧化锗加入浓盐酸后,蒸馏得到粗四氯化锗,粗四氯化锗经多步转化得到锗。
(1)由分析可知,浸渣的主要成分为硫酸铅、硫、二氧化硅;浸出时二硫化锗与氧气和稀硫酸反应生成硫酸锗、硫和水,反应的离子方程式为${GeS_{2} +4H^{+} +O_{2}\xlongequal{}Ge^{4+} +2S +2H_{2}O}$。
(2)由离子方程式可知,溶液${pH}$过低,溶液中氢离子浓度过大,使平衡向逆反应方向移动,导致沉锗率下降;适当加热、增大单宁酸的浓度、搅拌等措施能提高沉锗速率。
(3)四氯化锗分子中锗原子的价层电子对数为4、孤对电子对数为0,分子的空间构型为结构对称的正四面体形,属于非极性分子,三氯化砷分子中砷原子的价层电子对数为4、孤对电子对数为1,分子的空间构型为结构不对称的三角锥形,属于极性分子,极性分子的分子间作用力大于非极性分子,沸点高于非极性分子,所以三氯化砷的沸点高于四氯化锗。
(4)四羟基合锌离子中中心离子为锌离子,氢氧根离子中的氧原子为配位原子,电解时,四羟基合锌离子在阴极得到电子发生还原反应生成锌和氢氧根离子,电极反应式为${[Zn(OH)_{4}]^{2-} +2e^{-}\xlongequal{}Zn +4OH^{-}}$。
答案
(1)${SiO_{2}}$、${GeS_{2} +4H^{+} +O_{2}\xlongequal{}Ge^{4+} +2S +2H_{2}O}$
(2)沉锗平衡逆向移动 适当加热(或增大单宁酸的浓度、搅拌,合理即可)
(3) 三角锥形 ${AsCl_{3}}$为极性分子,分子间作用力比${GeCl_{4}}$大,所以${AsCl_{3}}$沸点比${GeCl_{4}}$高
(4)${O}$ ${[Zn(OH)_{4}]^{2-} +2e^{-}\xlongequal{}Zn +4OH^{-}}$
(1)由分析可知,浸渣的主要成分为硫酸铅、硫、二氧化硅;浸出时二硫化锗与氧气和稀硫酸反应生成硫酸锗、硫和水,反应的离子方程式为${GeS_{2} +4H^{+} +O_{2}\xlongequal{}Ge^{4+} +2S +2H_{2}O}$。
(2)由离子方程式可知,溶液${pH}$过低,溶液中氢离子浓度过大,使平衡向逆反应方向移动,导致沉锗率下降;适当加热、增大单宁酸的浓度、搅拌等措施能提高沉锗速率。
(3)四氯化锗分子中锗原子的价层电子对数为4、孤对电子对数为0,分子的空间构型为结构对称的正四面体形,属于非极性分子,三氯化砷分子中砷原子的价层电子对数为4、孤对电子对数为1,分子的空间构型为结构不对称的三角锥形,属于极性分子,极性分子的分子间作用力大于非极性分子,沸点高于非极性分子,所以三氯化砷的沸点高于四氯化锗。
(4)四羟基合锌离子中中心离子为锌离子,氢氧根离子中的氧原子为配位原子,电解时,四羟基合锌离子在阴极得到电子发生还原反应生成锌和氢氧根离子,电极反应式为${[Zn(OH)_{4}]^{2-} +2e^{-}\xlongequal{}Zn +4OH^{-}}$。
答案
(1)${SiO_{2}}$、${GeS_{2} +4H^{+} +O_{2}\xlongequal{}Ge^{4+} +2S +2H_{2}O}$
(2)沉锗平衡逆向移动 适当加热(或增大单宁酸的浓度、搅拌,合理即可)
(3) 三角锥形 ${AsCl_{3}}$为极性分子,分子间作用力比${GeCl_{4}}$大,所以${AsCl_{3}}$沸点比${GeCl_{4}}$高
(4)${O}$ ${[Zn(OH)_{4}]^{2-} +2e^{-}\xlongequal{}Zn +4OH^{-}}$
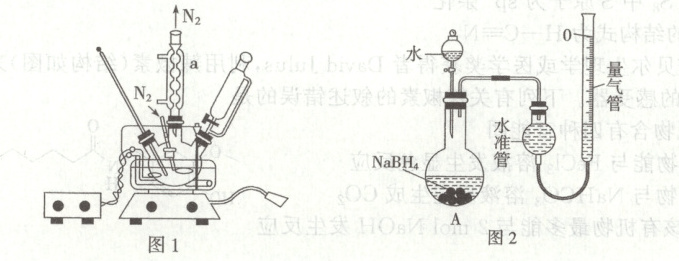
16. (14分)$NaBH_4$是常用络合型氢化物,常温下为白色结晶粉末,具有吸湿性,在干燥空气中可以稳定存在,溶于水、液氨、胺类等。制备方法:
步骤1 酯化
反应装置内按化学计量加入$H_3BO_3$和$CH_3OH$,在$54\ {^{\circ}C}$回流2h之后,开始收集$B(OCH_3)_3$(硼酸三甲酯)与$CH_3OH$的共沸物,控制温度$54$~$55\ {^{\circ}C}$。共沸液经硫酸酸洗后进行精馏,得到硼酸三甲酯。
步骤2 氢化
将金属钠分散于石蜡油中,通入氢气合成氢化钠。
步骤3 缩合
硼酸三甲酯和氢化钠在石蜡油介质中反应合成硼氢化钠,将物料冷却至$100\ {^{\circ}C}$以下,进行离心分离得到硼氢化钠滤饼粗品。
步骤4 水解
将上述硼氢化钠滤饼粗品置于容器中加水,发生反应$NaOCH_3+H_2O\xlongequal{}NaOH+CH_3OH$;将此水溶液离心分离,清液送入分层器,静置1h后分层。得到硼氢化钠碱性水溶液。
$pH$和温度对硼氢化钠水解半衰期(天)的影响:

回答下列问题:
(1)已知电负性$B<H$,硼氢化钠与水反应生成$NaBO_2$,反应的化学方程式为
(2)步骤1中,硫酸的作用:
(3)$NaBH_4$溶液浓度可采用如下方法测定(装置如图2所示):$25\ {^{\circ}C}$,常压下,用移液管移取$2.00\ mL$的$NaBH_4$溶液于烧瓶中,记录量气管起始体积读数$V_1\ mL$,加入液体,反应结束后调整量气管,记录读数为$V_2\ mL$。$NaBH_4$的浓度为
注:$25\ {^{\circ}C}$,常压下气体摩尔体积约为$24.5\ L·mol^{-1}$。
(4)若气体生成结束后,水准管中的液面低于量气管中的液面,此时量气管读数$V_2$会
步骤1 酯化
反应装置内按化学计量加入$H_3BO_3$和$CH_3OH$,在$54\ {^{\circ}C}$回流2h之后,开始收集$B(OCH_3)_3$(硼酸三甲酯)与$CH_3OH$的共沸物,控制温度$54$~$55\ {^{\circ}C}$。共沸液经硫酸酸洗后进行精馏,得到硼酸三甲酯。
步骤2 氢化
将金属钠分散于石蜡油中,通入氢气合成氢化钠。
步骤3 缩合
硼酸三甲酯和氢化钠在石蜡油介质中反应合成硼氢化钠,将物料冷却至$100\ {^{\circ}C}$以下,进行离心分离得到硼氢化钠滤饼粗品。
步骤4 水解
将上述硼氢化钠滤饼粗品置于容器中加水,发生反应$NaOCH_3+H_2O\xlongequal{}NaOH+CH_3OH$;将此水溶液离心分离,清液送入分层器,静置1h后分层。得到硼氢化钠碱性水溶液。

$pH$和温度对硼氢化钠水解半衰期(天)的影响:

回答下列问题:
(1)已知电负性$B<H$,硼氢化钠与水反应生成$NaBO_2$,反应的化学方程式为
NaBH4 +2H2O = 4H2↑ +NaBO2
。(2)步骤1中,硫酸的作用:
除去甲醇
,步骤3可在如图1所示装置中进行,仪器a的名称:球形冷凝管
,反应进行前通入氮气的目的是除去反应器中的空气
,步骤4中,硼氢化钠能够稳定存在的原因:反应过程中产生了碱,硼氢化钠在强碱性溶液中可以稳定存在
。(3)$NaBH_4$溶液浓度可采用如下方法测定(装置如图2所示):$25\ {^{\circ}C}$,常压下,用移液管移取$2.00\ mL$的$NaBH_4$溶液于烧瓶中,记录量气管起始体积读数$V_1\ mL$,加入液体,反应结束后调整量气管,记录读数为$V_2\ mL$。$NaBH_4$的浓度为
(V1-V2)/196 mol·L-1
(用含$V_1$、$V_2$的代数式表达)。注:$25\ {^{\circ}C}$,常压下气体摩尔体积约为$24.5\ L·mol^{-1}$。
(4)若气体生成结束后,水准管中的液面低于量气管中的液面,此时量气管读数$V_2$会
偏大
(填“偏大”“偏小”或“无影响”),需要将量气管慢慢向下
(填“向上”或“向下”)移动。
答案:
16.解析
(1)电负性:${B < H}$,故硼氢化钠中${B}$为$+3$价,${H}$为$-1$价,生成的${NaBO_{2}}$中${B}$为$+3$价,${B}$化合价不变;$-1$价的${H}$和水中$+1$价的${H}$生成${H_{2}}$,反应的化学方程式为${NaBH_{4} +2H_{2}O\xlongequal{}4H_{2}\uparrow +NaBO_{2}}$。
(2)步骤1中,硫酸的作用是除去甲醇,如图1所示装置中仪器${a}$的名称为球形冷凝管,反应进行前通入氮气的目的是除去反应器中的空气,步骤4中,硼氢化钠能够稳定存在的原因是反应过程中产生了碱,由${pH}$对硼氢化钠水解半衰期的影响可知,硼氢化钠在强碱性溶液中可以稳定存在。
(3)量气管两次读数之差$V_{1}-V_{2}$即为产生的${H_{2}}$体积,故产生${H_{2}}$物质的量为$\dfrac{(V_{1}-V_{2})\ {mL}}{24\ 500\ {mL· mol^{-1}}}=\dfrac{(V_{1}-V_{2})}{24\ 500}\ {mol}$,根据第一小题中的化学方程式,$2.00\ {mL}$的${NaBH_{4}}$溶液中含物质的量为$n({NaBH_{4}})=\dfrac{1}{4}n({H_{2}})=\dfrac{(V_{1}-V_{2})}{98\ 000}\ {mol}$,则$c({NaBH_{4}})=\dfrac{n({NaBH_{4}})}{V}=\dfrac{\dfrac{(V_{1}-V_{2})}{98\ 000}\ {mol}}{0.002\ {L}}=\dfrac{V_{1}-V_{2}}{196}\ {mol· L^{-1}}$。
(4)若气体生成结束后,水准管中的液面低于量气管中的液面,即量气管液面高,调整至两管液面齐平时,量气管向下移动才能使两管液面齐平,则原来量气管内液面位置偏低,量气管读数$V_{2}$会偏大。需要将量气管慢慢向下移动调整液面。
答案
(1)${NaBH_{4} +2H_{2}O\xlongequal{}4H_{2}\uparrow +NaBO_{2}}$
(2)除去甲醇 球形冷凝管 除去反应器中的空气 反应过程中产生了碱,硼氢化钠在强碱性溶液中可以稳定存在
(3)$\dfrac{V_{1}-V_{2}}{196}\ {mol· L^{-1}}$
(4)偏大 向下
(1)电负性:${B < H}$,故硼氢化钠中${B}$为$+3$价,${H}$为$-1$价,生成的${NaBO_{2}}$中${B}$为$+3$价,${B}$化合价不变;$-1$价的${H}$和水中$+1$价的${H}$生成${H_{2}}$,反应的化学方程式为${NaBH_{4} +2H_{2}O\xlongequal{}4H_{2}\uparrow +NaBO_{2}}$。
(2)步骤1中,硫酸的作用是除去甲醇,如图1所示装置中仪器${a}$的名称为球形冷凝管,反应进行前通入氮气的目的是除去反应器中的空气,步骤4中,硼氢化钠能够稳定存在的原因是反应过程中产生了碱,由${pH}$对硼氢化钠水解半衰期的影响可知,硼氢化钠在强碱性溶液中可以稳定存在。
(3)量气管两次读数之差$V_{1}-V_{2}$即为产生的${H_{2}}$体积,故产生${H_{2}}$物质的量为$\dfrac{(V_{1}-V_{2})\ {mL}}{24\ 500\ {mL· mol^{-1}}}=\dfrac{(V_{1}-V_{2})}{24\ 500}\ {mol}$,根据第一小题中的化学方程式,$2.00\ {mL}$的${NaBH_{4}}$溶液中含物质的量为$n({NaBH_{4}})=\dfrac{1}{4}n({H_{2}})=\dfrac{(V_{1}-V_{2})}{98\ 000}\ {mol}$,则$c({NaBH_{4}})=\dfrac{n({NaBH_{4}})}{V}=\dfrac{\dfrac{(V_{1}-V_{2})}{98\ 000}\ {mol}}{0.002\ {L}}=\dfrac{V_{1}-V_{2}}{196}\ {mol· L^{-1}}$。
(4)若气体生成结束后,水准管中的液面低于量气管中的液面,即量气管液面高,调整至两管液面齐平时,量气管向下移动才能使两管液面齐平,则原来量气管内液面位置偏低,量气管读数$V_{2}$会偏大。需要将量气管慢慢向下移动调整液面。
答案
(1)${NaBH_{4} +2H_{2}O\xlongequal{}4H_{2}\uparrow +NaBO_{2}}$
(2)除去甲醇 球形冷凝管 除去反应器中的空气 反应过程中产生了碱,硼氢化钠在强碱性溶液中可以稳定存在
(3)$\dfrac{V_{1}-V_{2}}{196}\ {mol· L^{-1}}$
(4)偏大 向下
查看更多完整答案,请扫码查看


