2026年薪火金卷高考仿真模拟卷化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年薪火金卷高考仿真模拟卷化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
17. (14分)氨具有较高的含氢量,可用作内燃机的燃料。回答下列问题:
(1)液氨是重要的非水溶剂,和水类似,液氨的电离平衡为$ 2{NH_{3} \rightleftharpoons NH^{+}_{4} + NH^{-}_{2}} 。$写出$ {NH_{4}Cl} $与$ {KNH_{2}} $在液氨中发生中和反应的离子方程式为。
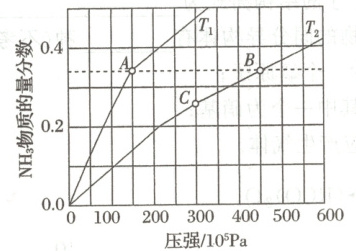
(2)合成氨反应的方程式为$ 3{H_{2}(g) + N_{2}(g) \rightleftharpoons 2NH_{3}(g)} ,$恒压密闭容器中,起始时$ n({H_{2}}) : n({N_{2}}) = 3 : 1 ,$不同温度 (T) 下平衡混合物中$ {NH_{3}} $物质的量分数随压强的变化曲线如图所示。
$① 25^{\circ}C $时$, {H_{2}(g)} $和$ {NH_{3}(g)} $的燃烧热$ \Delta H $分别为$ a\ kJ · mol^{-1} $和$ b\ kJ · mol^{-1} ,$上述合成氨反应的焓变为$ kJ · mol^{-1} 。$
② A 点温度迅速从$ T_{1} $变为$ T_{2} ,$则此时浓度商 Q (填“ > ”“ < ”或$“ = ”) K(T_{2}) 。$
$③ K_{p}(A) : K_{p}(B) =$$ ( K_{p} $为以分压表示的平衡常数,分压 = 总压 × 物质的量分数)。
④合成氨逆反应速率方程为 v(逆) = k(逆$)\dfrac{p^{2}_{{NH_{3}}}}{p^{3}_{{H_{2}}}} ,$式中 k(逆) 为逆反应的速率常数(只与温度有关)。从 C 点开始减小压强,平衡发生移动,直至达到新的平衡, v(逆) 的变化过程为。
$(3) {NH_{3}} 、$$ {NH_{3}BH_{3}} ($氨硼烷)储氢量高,是具有广泛应用前景的储氢材料。

$① {NH_{3}} $的中心原子的杂化轨道类型为。
$② {NH_{3}BH_{3}} $存在配位键,提供空轨道的是。
③比较熔点$: {NH_{3}BH_{3}} ($填“ > ”或$“ < ”) {CH_{3}CH_{3}} 。$
(1)液氨是重要的非水溶剂,和水类似,液氨的电离平衡为$ 2{NH_{3} \rightleftharpoons NH^{+}_{4} + NH^{-}_{2}} 。$写出$ {NH_{4}Cl} $与$ {KNH_{2}} $在液氨中发生中和反应的离子方程式为。
(2)合成氨反应的方程式为$ 3{H_{2}(g) + N_{2}(g) \rightleftharpoons 2NH_{3}(g)} ,$恒压密闭容器中,起始时$ n({H_{2}}) : n({N_{2}}) = 3 : 1 ,$不同温度 (T) 下平衡混合物中$ {NH_{3}} $物质的量分数随压强的变化曲线如图所示。

$① 25^{\circ}C $时$, {H_{2}(g)} $和$ {NH_{3}(g)} $的燃烧热$ \Delta H $分别为$ a\ kJ · mol^{-1} $和$ b\ kJ · mol^{-1} ,$上述合成氨反应的焓变为$ kJ · mol^{-1} 。$
② A 点温度迅速从$ T_{1} $变为$ T_{2} ,$则此时浓度商 Q (填“ > ”“ < ”或$“ = ”) K(T_{2}) 。$
$③ K_{p}(A) : K_{p}(B) =$$ ( K_{p} $为以分压表示的平衡常数,分压 = 总压 × 物质的量分数)。
④合成氨逆反应速率方程为 v(逆) = k(逆$)\dfrac{p^{2}_{{NH_{3}}}}{p^{3}_{{H_{2}}}} ,$式中 k(逆) 为逆反应的速率常数(只与温度有关)。从 C 点开始减小压强,平衡发生移动,直至达到新的平衡, v(逆) 的变化过程为。
$(3) {NH_{3}} 、$$ {NH_{3}BH_{3}} ($氨硼烷)储氢量高,是具有广泛应用前景的储氢材料。

$① {NH_{3}} $的中心原子的杂化轨道类型为。
$② {NH_{3}BH_{3}} $存在配位键,提供空轨道的是。
③比较熔点$: {NH_{3}BH_{3}} ($填“ > ”或$“ < ”) {CH_{3}CH_{3}} 。$
答案:
17.解析
(1)液氨是重要的非水溶剂,和水类似,液氨的电离平衡为$2NH_{3}\rightleftharpoons NH_{4}^{+}+NH_{2}^{-}$,则$NH_{4}^{+}$类似氢离子、$NH_{2}^{-}$类似氢氧根离子,$NH_{4}Cl$与$KNH_{2}$在液氨中发生中和反应生成氯化钾和液氨,反应的离子方程式为$NH_{4}^{+}+NH_{2}^{-}=2NH_{3}\uparrow$。
(2)①$25^{\circ}C$时,$H_{2}(g)$和$NH_{3}(g)$的燃烧热分别为$a\ kJ· mol^{- 1}$和$b\ kJ· mol^{- 1}$,则有:
Ⅰ:$H_{2}(g)+\frac{1}{2}O_{2}(g)=H_{2}O(l)$ $\Delta H = a\ kJ· mol^{- 1}$
Ⅱ:$NH_{3}(g)+\frac{3}{4}O_{2}(g)=\frac{3}{2}H_{2}O(l)+\frac{1}{2}N_{2}(g)$ $\Delta H = b\ kJ· mol^{- 1}$
由盖斯定律可知,$3×$Ⅰ$- 2×$Ⅱ得反应:$3H_{2}(g)+N_{2}(g)\rightleftharpoons 2NH_{3}(g)$ $\Delta H=(3a - 2b)kJ· mol^{- 1}$。
②由图可知,相同条件下,$T_{1}$时氨气含量更高,则A点的温度迅速从$T_{1}$变为$T_{2}$,则变化后体系中氨气含量高于变化后达到平衡体系中氨气含量,则反应逆向进行,故此时浓度商$Q > K(T_{2})$。
③反应中$K_{p}=\frac{[p_{总}×\alpha(NH_{3})]^{2}}{[p_{总}×\alpha(H_{2})]^{3}[p_{总}×\alpha(N_{2})]}=\frac{1}{p_{总}^{2}}×\frac{\alpha^{2}(NH_{3})}{\alpha^{3}(H_{2})×\alpha(N_{2})}$,由图可知,A、B两点氨气、氢气、氮气的物质的量的分数均相同,则$K_{p}(B):K_{p}(A)=\frac{p_{总}^{2}(A)}{p_{总}^{2}(B)}=(\frac{150×10^{5}}{450×10^{5}})^{2}=\frac{1}{9}$。
④$v(逆)=k(逆)\frac{p_{NH_{3}}^{2}}{p_{H_{2}}^{3}}$,$k(逆)$只与温度有关;从C点开始减小压强,相当于增大体积,各物质的分压均减小相同的倍数,由表达式可知,$p_{H_{2}}^{3}$减小对$v(逆)$影响更大,则$v(逆)$瞬间变大,然后逐渐减小,直至达到新的平衡,$v(逆)$不再改变。
(3)①$NH_{3}$的中心N原子的价层电子对数为$3+\frac{5 - 1×3}{2}=4$,N原子为$sp^{3}$杂化。
②$NH_{3}$中心N原子存在孤电子对,$BH_{3}$中B存在空轨道,两者形成配位键时B提供空轨道。
③$NH_{3}BH_{3}$中存在氨气分子结构,能形成分子间氢键,因此其熔点高于$CH_{3}CH_{3}$。
答案
(1)$NH_{4}^{+}+NH_{2}^{-}=2NH_{3}\uparrow$
(2)①$3a - 2b$ ②$>$ ③$\frac{1}{9}$(或$1:9$) ④$v(逆)$瞬间变大,然后逐渐减小,直至达到新的平衡,$v(逆)$不再改变
(3)①$sp^{3}$ ②B ③$>$
(1)液氨是重要的非水溶剂,和水类似,液氨的电离平衡为$2NH_{3}\rightleftharpoons NH_{4}^{+}+NH_{2}^{-}$,则$NH_{4}^{+}$类似氢离子、$NH_{2}^{-}$类似氢氧根离子,$NH_{4}Cl$与$KNH_{2}$在液氨中发生中和反应生成氯化钾和液氨,反应的离子方程式为$NH_{4}^{+}+NH_{2}^{-}=2NH_{3}\uparrow$。
(2)①$25^{\circ}C$时,$H_{2}(g)$和$NH_{3}(g)$的燃烧热分别为$a\ kJ· mol^{- 1}$和$b\ kJ· mol^{- 1}$,则有:
Ⅰ:$H_{2}(g)+\frac{1}{2}O_{2}(g)=H_{2}O(l)$ $\Delta H = a\ kJ· mol^{- 1}$
Ⅱ:$NH_{3}(g)+\frac{3}{4}O_{2}(g)=\frac{3}{2}H_{2}O(l)+\frac{1}{2}N_{2}(g)$ $\Delta H = b\ kJ· mol^{- 1}$
由盖斯定律可知,$3×$Ⅰ$- 2×$Ⅱ得反应:$3H_{2}(g)+N_{2}(g)\rightleftharpoons 2NH_{3}(g)$ $\Delta H=(3a - 2b)kJ· mol^{- 1}$。
②由图可知,相同条件下,$T_{1}$时氨气含量更高,则A点的温度迅速从$T_{1}$变为$T_{2}$,则变化后体系中氨气含量高于变化后达到平衡体系中氨气含量,则反应逆向进行,故此时浓度商$Q > K(T_{2})$。
③反应中$K_{p}=\frac{[p_{总}×\alpha(NH_{3})]^{2}}{[p_{总}×\alpha(H_{2})]^{3}[p_{总}×\alpha(N_{2})]}=\frac{1}{p_{总}^{2}}×\frac{\alpha^{2}(NH_{3})}{\alpha^{3}(H_{2})×\alpha(N_{2})}$,由图可知,A、B两点氨气、氢气、氮气的物质的量的分数均相同,则$K_{p}(B):K_{p}(A)=\frac{p_{总}^{2}(A)}{p_{总}^{2}(B)}=(\frac{150×10^{5}}{450×10^{5}})^{2}=\frac{1}{9}$。
④$v(逆)=k(逆)\frac{p_{NH_{3}}^{2}}{p_{H_{2}}^{3}}$,$k(逆)$只与温度有关;从C点开始减小压强,相当于增大体积,各物质的分压均减小相同的倍数,由表达式可知,$p_{H_{2}}^{3}$减小对$v(逆)$影响更大,则$v(逆)$瞬间变大,然后逐渐减小,直至达到新的平衡,$v(逆)$不再改变。
(3)①$NH_{3}$的中心N原子的价层电子对数为$3+\frac{5 - 1×3}{2}=4$,N原子为$sp^{3}$杂化。
②$NH_{3}$中心N原子存在孤电子对,$BH_{3}$中B存在空轨道,两者形成配位键时B提供空轨道。
③$NH_{3}BH_{3}$中存在氨气分子结构,能形成分子间氢键,因此其熔点高于$CH_{3}CH_{3}$。
答案
(1)$NH_{4}^{+}+NH_{2}^{-}=2NH_{3}\uparrow$
(2)①$3a - 2b$ ②$>$ ③$\frac{1}{9}$(或$1:9$) ④$v(逆)$瞬间变大,然后逐渐减小,直至达到新的平衡,$v(逆)$不再改变
(3)①$sp^{3}$ ②B ③$>$
查看更多完整答案,请扫码查看


