2026年薪火金卷高考仿真模拟卷化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年薪火金卷高考仿真模拟卷化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
12. 电池级高纯硫酸锰 $ ({MnSO_{4} · H_{2}O}) $ 是制备锂电池正极三元材料(镍钴锰酸锂)的前驱体,也是制备电池级高纯四氧化三锰和高纯二氧化锰的基础原料。一种由软锰矿(主要成分是 $ {MnO_{2}} $,含有 $ {Fe} $、$ {Ca} $、$ {Mg} $、$ {Cu} $、$ {Zn} $ 等杂质元素)制备电池级高纯硫酸锰的工艺流程图如图所示:

$\begin{aligned}&{}\\\end{aligned}$
已知:常温下 $ K_{sp}[{Fe(OH)_{3}}] = 4 × 10^{-38} $。
下列说法错误的是(
A.工业上一般采用 $ {BaS} $ 除重金属 $ {Cu^{2+}} $、$ {Zn^{2+}} $,使其沉淀下来
B.往酸浸液中加入 $ {MnO_{2}} $ 的目的是将 $ {Fe^{2+}} $ 氧化为 $ {Fe^{3+}} $,也可选择 $ {H_{2}O_{2}} $ 或者 $ {Na_{2}O_{2}} $
C.常温下,调节溶液 $ {pH} = 4 $ 时,$ {Fe^{3+}} $ 已沉淀完全
D.过滤Ⅱ得到的滤渣的主要成分有 $ {CaF_{2}} $、$ {MgF_{2}} $、$ {CuS} $、$ {ZnS} $、$ {BaSO_{4}} $

$\begin{aligned}&{}\\\end{aligned}$
已知:常温下 $ K_{sp}[{Fe(OH)_{3}}] = 4 × 10^{-38} $。
下列说法错误的是(
B
)A.工业上一般采用 $ {BaS} $ 除重金属 $ {Cu^{2+}} $、$ {Zn^{2+}} $,使其沉淀下来
B.往酸浸液中加入 $ {MnO_{2}} $ 的目的是将 $ {Fe^{2+}} $ 氧化为 $ {Fe^{3+}} $,也可选择 $ {H_{2}O_{2}} $ 或者 $ {Na_{2}O_{2}} $
C.常温下,调节溶液 $ {pH} = 4 $ 时,$ {Fe^{3+}} $ 已沉淀完全
D.过滤Ⅱ得到的滤渣的主要成分有 $ {CaF_{2}} $、$ {MgF_{2}} $、$ {CuS} $、$ {ZnS} $、$ {BaSO_{4}} $
答案:
12.B [重金属硫化物大多是难溶于水的物质,加入BaS,可以与溶液中的$Cu^{2 + }$、$Zn^{2 + }$在水中形成CuS、ZnS沉淀分离除去,A正确;往酸浸液中加入$MnO_{2}$的目的是将$Fe^{2 + }$氧化为$Fe^{3 + }$,若选择使用$Na_{2}O_{2}$,会引入杂质$Na^{+}$,产生$Na_{2}SO_{4}$杂质,导致产物不纯净,B错误;常温下,调节溶液$pH = 4$时,$c(Fe^{3 + })=\frac{K_{sp}[Fe(OH)_{3}]}{c^{3}(OH^{-})}=\frac{4×10^{- 38}}{(1×10^{- 10})^{3}}mol· L^{- 1}=4×10^{- 8}mol· L^{- 1}$,$c(Fe^{3 + })<10^{- 5}mol· L^{- 1}$,故$Fe^{3 + }$已沉淀完全,C正确;金属氟化物与氯化物相反,往往难溶于水,可以形成滤渣除去,加入$F^{-}$可以与溶液中的$Ca^{2 + }$、$Mg^{2 + }$形成$CaF_{2}$、$MgF_{2}$沉淀,加入BaS除去$Cu^{2 + }$、$Zn^{2 + }$,同时有$BaSO_{4}$沉淀生成,D正确。]
13. 由 $ {CH_{3}CH_{2}OH} $ 和 $ {O_{2}} $ 构成的质子交换膜燃料电池的结构示意如图所示,电池总反应为 $ {CH_{3}CH_{2}OH + 3O_{2} = 2CO_{2} + 3H_{2}O} $,当通过质子交换膜 $ 2\ mol {H^{+}} $ 时,下列说法正确的是(
$\begin{aligned}&{}\\\end{aligned}$
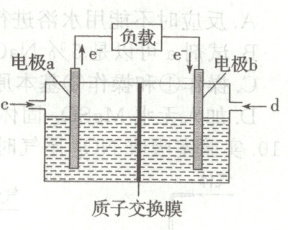
A.$ {a} $ 电极的电极反应式为 $ {CH_{3}CH_{2}OH + 3H_{2}O - 12e^{-} = 2CO_{2} + 12H^{+}} $
B.若用该燃料电池为铅蓄电池充电,电极 $ {b} $ 连接铅蓄电池的 $ {Pb} $ 极
C.燃料电池所消耗的 $ {O_{2}} $ 在标准状况下的体积为 $ 22.4\ L $
D.铅蓄电池中电解液质量增大 $ 80\ g $
A
)$\begin{aligned}&{}\\\end{aligned}$

A.$ {a} $ 电极的电极反应式为 $ {CH_{3}CH_{2}OH + 3H_{2}O - 12e^{-} = 2CO_{2} + 12H^{+}} $
B.若用该燃料电池为铅蓄电池充电,电极 $ {b} $ 连接铅蓄电池的 $ {Pb} $ 极
C.燃料电池所消耗的 $ {O_{2}} $ 在标准状况下的体积为 $ 22.4\ L $
D.铅蓄电池中电解液质量增大 $ 80\ g $
答案:
13.A [由图可知,a极失去$e^{-}$为负极,a电极的电极反应式为$CH_{3}CH_{2}OH + 3H_{2}O - 12e^{-}=2CO_{2}+12H^{+}$,A正确;电极b为正极,若用该燃料电池为铅蓄电池充电,电极b连接铅蓄电池的$PbO_{2}$极,B错误;电极b发生反应$O_{2}+4e^{-}+4H^{+}=2H_{2}O$,当通过质子交换膜$2molH^{+}$时,消耗$O_{2}$的物质的量为0.5mol,消耗$O_{2}$在标准状况下的体积为11.2L,C错误;铅蓄电池充电时的反应为$2PbSO_{4}+2H_{2}O\xlongequal{通电}Pb + PbO_{2}+2H_{2}SO_{4}$,根据关系式:$2H_{2}O\sim2H_{2}SO_{4}\sim2e^{-}$,每通过2mol电子时消耗2mol$H_{2}O$、生成2mol$H_{2}SO_{4}$,电解质溶液质量增加$2mol×98g/mol - 2mol×18g/mol = 160g$,D错误。]
14. 已知: $ pAg = -\lg c({Ag^{+}}) $,常温下向 $ 10\ mL\ 0.1\ mol · L^{-1} {AgNO_{3}} $ 溶液中滴加 $ 0.1\ mol · L^{-1} {NaCl} $ 溶液的滴定曲线Ⅰ如图所示。已知: $ K_{sp}({AgCl}) > K_{sp}({AgI}) $。下列说法正确的是(
$\begin{aligned}&{}\\\end{aligned}$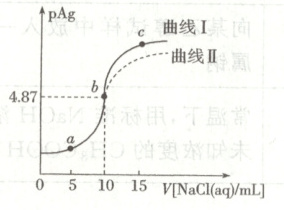
A.常温下,$ K_{sp}({AgCl}) = 1.0 × 10^{-5.87} $
B.溶液中水的电离程度: $ a = c < b $
C.$ c $ 点溶液中 $ c({Ag^{+}}) = 5 × 10^{-8.74}\ mol · L^{-1} $
D.将 $ {NaCl} $ 溶液换为等浓度的 $ {NaI} $ 溶液,图像变为曲线Ⅱ
C
)$\begin{aligned}&{}\\\end{aligned}$

A.常温下,$ K_{sp}({AgCl}) = 1.0 × 10^{-5.87} $
B.溶液中水的电离程度: $ a = c < b $
C.$ c $ 点溶液中 $ c({Ag^{+}}) = 5 × 10^{-8.74}\ mol · L^{-1} $
D.将 $ {NaCl} $ 溶液换为等浓度的 $ {NaI} $ 溶液,图像变为曲线Ⅱ
答案:
14.C [图中b点时$AgNO_{3}$和NaCl恰好反应,$c(Ag^{+}) = c(Cl^{-}) = 10^{- 4.87}mol· L^{- 1}$,则$K_{sp}(AgCl)=c(Ag^{+})· c(Cl^{-})=(10^{- 4.87})^{2}=1.0×10^{- 9.74}$,A错误;由图可知,$c(Ag^{+}):a > b > c$,$Ag^{+}$促进水的电离,并且$c(Ag^{+})$越大,促进作用越强,则溶液中水的电离程度:$a > b > c$,B错误;c点溶液中$c(Cl^{-})=\frac{5}{25}×0.1mol· L^{- 1}=0.02mol· L^{- 1}$,$K_{sp}(AgCl)=1.0×10^{- 9.74}$,则c点溶液中$c(Ag^{+})=\frac{1.0×10^{- 9.74}}{0.02}mol· L^{- 1}=5×10^{- 8.74}mol· L^{- 1}$,C正确;将NaCl溶液换为等浓度的NaI溶液恰好反应时消耗$V(NaI)=10mL$,但$K_{sp}(AgCl)>K_{sp}(AgI)$,则恰好反应时pAg较大,D错误。]
查看更多完整答案,请扫码查看


