2026年薪火金卷高考仿真模拟卷化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年薪火金卷高考仿真模拟卷化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
5. 我国科学家发现深海处在微生物作用下的含硫物质转化成 $HS^{-}$ 的变化过程如下图所示 (已略去部分不含硫物质)。有关转化过程的说法正确的是(
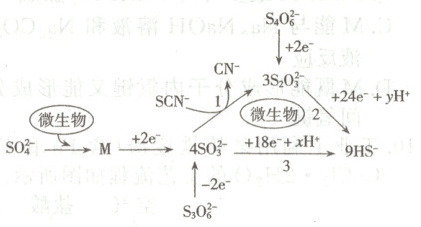
A.$x=21, y=24$
B.$SO_{3}^{2-}$ 与 $SCN^{-}$ 的反应中, $SO_{3}^{2-}$ 只作氧化剂, $SCN^{-}$ 只作还原剂
C.$SO_{4}^{2-} 、 ~S_{4} O_{6}^{2-} 、 ~S_{3} O_{6}^{2-}$ 在转化过程中硫元素的化合价均降低
D.理论上每产生 $1.2 ~mol HS^{-}, SO_{3}^{2-} 、 ~S_{2} O_{3}^{2-}$ 共得到 $5.0 ~mol e^{-}$
A
)
A.$x=21, y=24$
B.$SO_{3}^{2-}$ 与 $SCN^{-}$ 的反应中, $SO_{3}^{2-}$ 只作氧化剂, $SCN^{-}$ 只作还原剂
C.$SO_{4}^{2-} 、 ~S_{4} O_{6}^{2-} 、 ~S_{3} O_{6}^{2-}$ 在转化过程中硫元素的化合价均降低
D.理论上每产生 $1.2 ~mol HS^{-}, SO_{3}^{2-} 、 ~S_{2} O_{3}^{2-}$ 共得到 $5.0 ~mol e^{-}$
答案:
5.A [根据题干流程图可知,配平可得3S2O32−+24H++24e−=6HS−+9H2O,消耗24molH+,反应3SO32−+18e−+21H+=3HS−+9H2O,消耗21molH+,即x=21,y=24,A正确;SO32−与SCN−发生反应SO32−+SCN−=S2O32−+CN−,SO32−只作氧化剂,SCN−即作氧化剂又作还原剂,B错误;SO42−中S的化合价由+6价降低到SO32−的+4价,S4O62−中+2.5价的S降低到S2O32−中的+2价,S3O62−中+10/3价的S升高到SO32−中的+4价,C错误;理论上产生1.2molHS−,其中0.4mol HS−由SO32−还原得到,0.8molHS−由S2O32−还原得到,故SO32−、S2O32−共得到电子的物质的量为0.4mol×6+0.8mol×8=8.8mol,D错误。]
6. 以环己烯、氯仿和 $NaOH$ 为原料制备 , 反应过程中还需加人少量季铵盐 (以 $R_{4} ~N^{+} Cl^{-}$ 表示), 其作用机理如图所示。下列叙述错误的是(
, 反应过程中还需加人少量季铵盐 (以 $R_{4} ~N^{+} Cl^{-}$ 表示), 其作用机理如图所示。下列叙述错误的是(
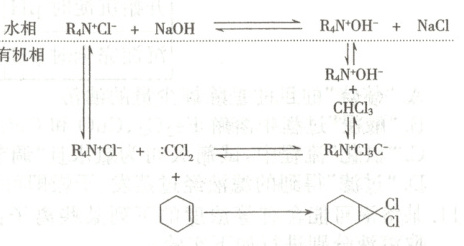
A.$R_{4} ~N^{+} Cl^{-}$ 的主要作用是将 $OH^{-}$ 转移到有机相中
B.为了保证反应产率, 实验过程中需要不断搅拌反应体系
C.: $CCl_{2}$ 是一种活性中间体, 能与碳碳双键发生反应
D.反应结束后通过水洗、干燥即可得到纯净的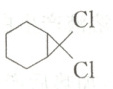
 , 反应过程中还需加人少量季铵盐 (以 $R_{4} ~N^{+} Cl^{-}$ 表示), 其作用机理如图所示。下列叙述错误的是(
, 反应过程中还需加人少量季铵盐 (以 $R_{4} ~N^{+} Cl^{-}$ 表示), 其作用机理如图所示。下列叙述错误的是(D
)
A.$R_{4} ~N^{+} Cl^{-}$ 的主要作用是将 $OH^{-}$ 转移到有机相中
B.为了保证反应产率, 实验过程中需要不断搅拌反应体系
C.: $CCl_{2}$ 是一种活性中间体, 能与碳碳双键发生反应
D.反应结束后通过水洗、干燥即可得到纯净的

答案:
6.D [季铵盐(R4N+Cl−)与NaOH反应生成季铵碱,从而将OH−转移至有机相中,A正确;反应物中有机相和水相互不相溶,需要不断搅拌,增大反应物的接触面积,保证反应产率,B正确;由作用机理可知,:CCl2能与碳碳双键发生反应生成目标产物,C正确;反应结束后还可能存在其他有机副产物,需要通过蒸馏得到纯净的产物,D错误。]
7. 近日, 我国科学家开发了首例室温全固态氢负离子二次电池, 该电池通过固态氢负离子导体实现对 $H^{-}$ 的快速传导, 其工作原理如图所示, 其中放电时乙电极的电极反应式为 $M+x H^{-}-x e^{-}=MH_{x}$ ( $M$ 为 $Li 、 Na 、 ~K 、 Mg 、 Ti$ 等金属)。下列说法错误的是(
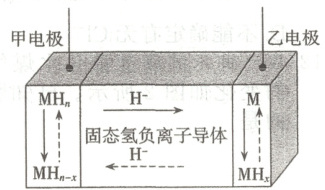
A.放电时, 电子经外电路流向甲电极
B.放电时, 氢负离子移向乙电极
C.充电时, 甲电极发生的反应可表示为 $MH_{n-x}+x H^{-}-x e^{-}=MH_{n}$
D.可将固态离子导体替换成水溶液电解质, 对氢负离子进行传导
D
)
A.放电时, 电子经外电路流向甲电极
B.放电时, 氢负离子移向乙电极
C.充电时, 甲电极发生的反应可表示为 $MH_{n-x}+x H^{-}-x e^{-}=MH_{n}$
D.可将固态离子导体替换成水溶液电解质, 对氢负离子进行传导
答案:
7.D [放电时,乙电极的电极反应式为M+xH−−xe−=MHx,则乙电极为负极,甲电极为正极,放电时,电子经外电路流向正极,A正确;放电时,阴离子(H−)移向负极,B正确;充电时,甲电极为阳极,发生氧化反应MHn−x+xH−−xe−=MHn,C正确;H−具有强还原性,可与水反应生成氢气,因此不可替换成水溶液电解质,D错误。]
8. $A 、 B 、 C 、 D 、 E 、 F$ 为短周期元素, 其中 $B$ 原子核外各轨道内含有相同的电子数, 它们的最高正价与原子半径关系如图所示。下列说法错误的是(

A.$BF_{2}$ 为共价化合物
B.第一电离能: $F>E>A$
C.最简单氢化物的熔点: $D>E$
D.$ECD^{-}$ 与 $Fe^{3+}$ 形成配位键时, $C$ 原子采取 $sp^{2}$ 杂化
D
)
A.$BF_{2}$ 为共价化合物
B.第一电离能: $F>E>A$
C.最简单氢化物的熔点: $D>E$
D.$ECD^{-}$ 与 $Fe^{3+}$ 形成配位键时, $C$ 原子采取 $sp^{2}$ 杂化
答案:
8.D [A为+1价,原子半径最大,A为钠(Na),B为+2价,且原子核外各轨道内含有相同的电子数,则B为铍(Be),C为+4价,原子半径小于B,故C为碳(C),D为+5价,原子半径小于C,则D为氮(N),E为+6价,原子半径大于D,则E为硫(S),F为+7价,原子半径大于D,则F为氯(Cl)。B为铍(Be),F为氯(Cl),BCl2中只含共价键,为共价化合物,A正确;F为氯(Cl),E为硫(S),A为钠(Na),同周期元素第一电离能从左到右是增大趋势,故第一电离能:Cl>S>Na,即F>E>A,B正确;D为氮(N),最简单氢化物为NH3(含分子间氢键);E为硫(S),最简单氢化物为H2S(无氢键),氢键使NH3熔点高于H2S,即D>E,C正确;ECD−为SCN−,与Fe3+配位时,SCN−中C原子形成2个σ键,无孤对电子,杂化方式为sp,D错误。]
查看更多完整答案,请扫码查看


