2026年薪火金卷高考仿真模拟卷化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年薪火金卷高考仿真模拟卷化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
11. 某化学小组欲通过测定混合气体中${O_{2}}$的含量来计算$2\ {g}$已变质的${Na_{2}O_{2}}$样品中${Na_{2}CO_{3}}$的含量。实验装置如图所示(${Q}$为弹性良好的气囊)。
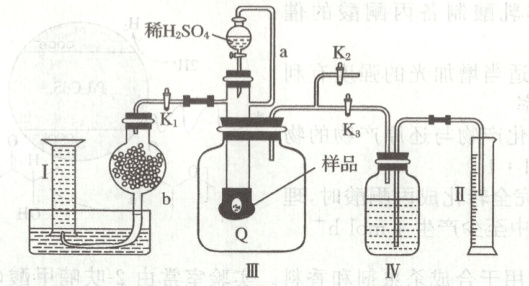
已知:①过氧化钠与稀硫酸反应的总化学方程式为${2Na_{2}O_{2} + 2H_{2}SO_{4}\xlongequal{}2Na_{2}SO_{4} + 2H_{2}O + O_{2}\uparrow}$;②忽略气体在Ⅱ和Ⅳ中的溶解。
下列说法正确的是(
A.${b}$的作用是除去气体中的${CO_{2}}$,故${b}$中应装有无水${CaCl_{2}}$
B.测定气体总体积必须关闭${K_{2}}$,打开${K_{1}}$、${K_{3}}$
C.量筒Ⅱ用于测量产生的气体${CO_{2}}$体积,量筒Ⅰ用于测量产生的${O_{2}}$体积
D.若量筒Ⅰ收集的气体折算为标准状况下是$224\ {mL}$,则$2\ {g}$已变质的样品中的${Na_{2}O_{2}}$质量为$1.56\ {g}$

已知:①过氧化钠与稀硫酸反应的总化学方程式为${2Na_{2}O_{2} + 2H_{2}SO_{4}\xlongequal{}2Na_{2}SO_{4} + 2H_{2}O + O_{2}\uparrow}$;②忽略气体在Ⅱ和Ⅳ中的溶解。
下列说法正确的是(
D
)A.${b}$的作用是除去气体中的${CO_{2}}$,故${b}$中应装有无水${CaCl_{2}}$
B.测定气体总体积必须关闭${K_{2}}$,打开${K_{1}}$、${K_{3}}$
C.量筒Ⅱ用于测量产生的气体${CO_{2}}$体积,量筒Ⅰ用于测量产生的${O_{2}}$体积
D.若量筒Ⅰ收集的气体折算为标准状况下是$224\ {mL}$,则$2\ {g}$已变质的样品中的${Na_{2}O_{2}}$质量为$1.56\ {g}$
答案:
11.D [关闭$K_{2}$,打开$K_{1}$、$K_{3}$,$Na_{2}O_{2}$样品与硫酸反应放出二氧化碳和氧气,Q膨胀排出Ⅲ内的空气,根据Ⅱ收集到水的体积即为产生二氧化碳和氧气的总体积;反应结束后,关闭$K_{3}$,打开$K_{1}$、$K_{2}$,Q中气体排入b,二氧化碳被b中碱石灰吸收,量筒Ⅰ收集到氧气。b的作用是为了除去气体中的$CO_{2}$,故b中应装碱石灰,A错误;反应产生的$O_{2}$和$CO_{2}$使气囊变大,将Ⅲ中的气体排出,水进入量筒Ⅱ中,所以量筒Ⅱ中水的体积即为产生$O_{2}$和$CO_{2}$的总体积,所以滴加稀硫酸前必须关闭$K_{1}$、$K_{2}$,打开$K_{3}$,B错误;结合分析可知,量筒Ⅱ用于测量产生的氧气和$CO_{2}$总体积,量筒Ⅰ用于测量产生的$O_{2}$体积,C错误;量筒Ⅰ收集的气体是氧气,若量筒Ⅰ收集的气体折算后为0.01 mol,则过氧化钠的物质的量为0.02 mol,则2 g已变质的样品中的$Na_{2}O_{2}$质量为1.56 g,D正确。]
12. 实验室制备${FeCO_{3}}$的流程如图所示,下列叙述不正确的是(
${NH_{4}HCO_{3}}$溶液
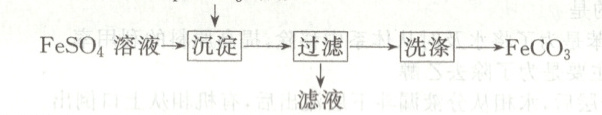
A.可用${KSCN}$溶液检验${FeSO_{4}}$溶液是否变质
B.沉淀时可用冷水浴降温以防止${NH_{4}HCO_{3}}$分解
C.沉淀时的离子方程式:${Fe^{2+} + HCO^{-}_{3}\xlongequal{}FeCO_{3}\downarrow + H^{+}}$
D.为了使${FeCO_{3}}$快速干燥,洗涤操作时可用无水乙醇
C
)${NH_{4}HCO_{3}}$溶液

A.可用${KSCN}$溶液检验${FeSO_{4}}$溶液是否变质
B.沉淀时可用冷水浴降温以防止${NH_{4}HCO_{3}}$分解
C.沉淀时的离子方程式:${Fe^{2+} + HCO^{-}_{3}\xlongequal{}FeCO_{3}\downarrow + H^{+}}$
D.为了使${FeCO_{3}}$快速干燥,洗涤操作时可用无水乙醇
答案:
12.C [亚铁离子变质会生成铁离子,则检验硫酸亚铁溶液是否变质,可用KSCN溶液检验,若溶液变红,则证明硫酸亚铁溶液变质了,A正确;$NH_{4}HCO_{3}$受热易分解,所以加入$NH_{4}HCO_{3}$溶液生成$FeCO_{3}$沉淀时,可用冷水浴降温以防止$NH_{4}HCO_{3}$分解,B正确;硫酸亚铁与$NH_{4}HCO_{3}$发生反应的离子方程式为$Fe^{2 + } + 2HCO^{-}_{3} = FeCO_{3}\downarrow + H_{2}O + CO_{2}\uparrow$,C错误;$FeCO_{3}$易被氧气氧化,难溶于乙醇,为防止其被氧化,洗涤时可用无水乙醇除去水分,快速干燥,D正确。]
13. 用一种具有“卯榫”结构的双极膜组装的电解池可实现大电流催化电解氯化铵废水,同时制得盐酸和氨水。工作时,${H_{2}O}$在双极膜界面处被催化解离成${H^{+}}$和${OH^{-}}$,有利于电解反应顺利进行,装置如图所示(${M}$、${N}$均为惰性电极)。下列说法正确的是(
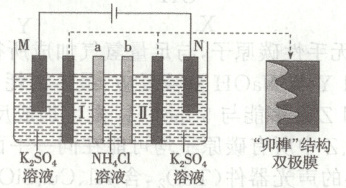
A.${a}$膜是阳离子交换膜,${b}$膜是阴离子交换膜
B.Ⅰ室生成氨水,Ⅱ室生成盐酸
C.每生成$0.1\ {mol}\ {HCl}$,双极膜处共有$0.2\ {mol}$ ${H_{2}O}$解离
D.与平面结构相比,“卯榫”结构双极膜表面积大,更有利于电子通过
C
)
A.${a}$膜是阳离子交换膜,${b}$膜是阴离子交换膜
B.Ⅰ室生成氨水,Ⅱ室生成盐酸
C.每生成$0.1\ {mol}\ {HCl}$,双极膜处共有$0.2\ {mol}$ ${H_{2}O}$解离
D.与平面结构相比,“卯榫”结构双极膜表面积大,更有利于电子通过
答案:
13.C [阳离子向阴极移动、阴离子向阳极移动,氯离子透过a膜进入Ⅰ室,铵根离子透过b膜进入Ⅱ室,a膜是阴离子交换膜、b膜是阳离子交换膜,A错误;氯离子透过a膜进入Ⅰ室,铵根离子透过b膜进入Ⅱ室,可知在Ⅰ、Ⅱ两室分别得到盐酸和氨水,B错误;生成0.1 mol HCl,Ⅰ室处双极膜有0.1 mol $H_{2}O$解离、Ⅱ室处双极膜有0.1 mol $H_{2}O$解离,所以双极膜处共有0.2 mol $H_{2}O$解离,C正确;与平面结构的双极膜相比,“卵榫”结构增大双极膜面积,可提高产品生成速率,电子不能通过双极膜,D错误。]
14. 向$20\ {mL}\ 0.1\ {mol· L^{-1}}\ {H_{2}A}$溶液中滴加$0.1\ {mol· L^{-1}}\ {NaOH}$溶液,${H_{2}A}$、${HA^{-}}$、${A^{2-}}$的百分含量${\delta [\delta (H_{2}A)=\dfrac{c(H_{2}A)}{c(H_{2}A) + c(HA^{-}) + c(A^{2-})}]}$随溶液${pH}$的变化如图所示:
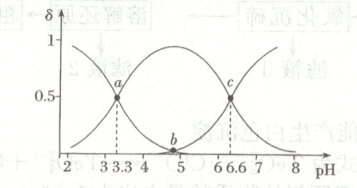
下列说法正确的是(
A.${K_{a2}}$的数量级为$10^{-6}$
B.${a}$点对应的${V(NaOH)=10\ {mL}}$
C.${b}$点$c{(HA^{-}) + 2c(A^{2-})=0.1\ {mol· L^{-1}}}$
D.${c}$点$3c{(A^{2-}) + c(OH^{-})=c(H^{+}) + c(Na^{+})}$

下列说法正确的是(
D
)A.${K_{a2}}$的数量级为$10^{-6}$
B.${a}$点对应的${V(NaOH)=10\ {mL}}$
C.${b}$点$c{(HA^{-}) + 2c(A^{2-})=0.1\ {mol· L^{-1}}}$
D.${c}$点$3c{(A^{2-}) + c(OH^{-})=c(H^{+}) + c(Na^{+})}$
答案:
14.D [c点$c(HA^{-}) = c(A^{2 - })$,$K_{a2} = \frac{c(H^{+}) · c(A^{2 - })}{c(HA^{-})} = c(H^{+}) = 10^{- 6.6}$,数量级为$10^{- 7}$,A错误;a点$c(HA^{-}) = c(H_{2}A)$,当滴加10 mL NaOH溶液时,二者恰好反应生成NaHA,由于$HA^{-}$的电离和水解程度不同,$c(HA^{-}) \neq c(H_{2}A)$,B错误;b点存在电荷守恒:$c(OH^{-}) + c(HA^{-}) + 2c(A^{2 - }) = c(H^{+}) + c(Na^{+})$,此时溶液呈酸性,$c(OH^{-}) < c(H^{+})$,$c(Na^{+}) < 0.1\ mol · L^{- 1}$,$c(H^{+})$和$c(OH^{-})$很小基本可以忽略,则$c(HA^{-}) + 2c(A^{2 - }) = c(Na^{+}) + c(H^{+}) - c(OH^{-}) < 0.1\ mol · L^{- 1}$,C错误;c点$c(HA^{-}) = c(A^{2 - })$,存在电荷守恒:$c(OH^{-}) + c(HA^{-}) + 2c(A^{2 - }) = c(H^{+}) + c(Na^{+})$,则$3c(A^{2 - }) + c(OH^{-}) = c(H^{+}) + c(Na^{+})$,D正确。]
查看更多完整答案,请扫码查看


