2026年薪火金卷高考仿真模拟卷化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年薪火金卷高考仿真模拟卷化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
16. (14 分) $NH_{4} CuSO_{3}$ (亚硫酸亚铜铵) 是一种白色难溶于水的化工产品, 在空气中易变质, 难溶于酒精。某小组设计实验制备 $NH_{4} CuSO_{3}$, 并探究 $SO_{2}$ 的漂白原理。已知: 品红易溶于酒精和水。
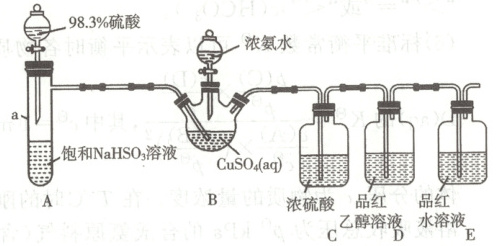
实验操作: 先向 $B$ 中加人浓氨水至蓝色沉淀恰好溶解, 再启动 $A$ 中反应, $B$ 中产生白色沉淀, $D$ 中红色不变色, $E$ 中红色溶液变为无色溶液。
回答下列问题:
(1) 仪器 $a$ 的名称是
(2) 实验完毕后, 分离 $B$ 中产品的操作是
(3) 由 $D 、 E$ 中实验现象说明, $SO_{2}$ 漂白品红必须在
(4) 取少量产品于试管中, 滴加稀硫酸, 发现溶液变蓝色, 生成红色固体, 产生的气体通人酸性 $KMnO_{4}$ 溶液中, 溶液由紫色变为无色。写出 $NH_{4} CuSO_{3}$ 和稀硫酸反应的离子方程式:
(5) 取 $m g NH_{4} CuSO_{3}$ 产品于雉形瓶中, 加人适量稀硫酸, 充分反应后, 加蒸馏水稀释至 $250 ~mL$, 取 $25.00 ~mL$, 加人足量 $KI$ 溶液, 滴几滴淀粉溶液, 用 $0.1000 ~mol · L^{-1} Na_{2} ~S_{2} O_{3}$ 溶液滴定至终点, 消耗滴定液 $20.00 ~mL$ 。该产品纯度为
已知: 有关滴定反应为 $2 Cu^{2+}+4 I^{-}=2 CuI \downarrow+I_{2}, I_{2}+2 ~S_{2} O_{3}^{2-}=2 I^{-}+S_{4} O_{6}^{2-}$ 。 $S_{2} O_{3}^{2-}+2 H^{+}=SO_{2} \uparrow+2 ~S \downarrow+H_{2} O$ 。

实验操作: 先向 $B$ 中加人浓氨水至蓝色沉淀恰好溶解, 再启动 $A$ 中反应, $B$ 中产生白色沉淀, $D$ 中红色不变色, $E$ 中红色溶液变为无色溶液。
回答下列问题:
(1) 仪器 $a$ 的名称是
具支试管
; $C$ 装置的作用是吸收尾气中的NH3和水,防止其影响SO2的漂白性实验
。(2) 实验完毕后, 分离 $B$ 中产品的操作是
过滤
、酒精洗涤、干燥。用酒精替代水洗涤的目的是减小NH4CuSO3的溶解度,减小损失
。(3) 由 $D 、 E$ 中实验现象说明, $SO_{2}$ 漂白品红必须在
H2O
(填化学式) 存在条件下进行。(4) 取少量产品于试管中, 滴加稀硫酸, 发现溶液变蓝色, 生成红色固体, 产生的气体通人酸性 $KMnO_{4}$ 溶液中, 溶液由紫色变为无色。写出 $NH_{4} CuSO_{3}$ 和稀硫酸反应的离子方程式:
2NH4CuSO3+4H+=2NH4++Cu2++Cu+2SO2↑+2H2O
。(5) 取 $m g NH_{4} CuSO_{3}$ 产品于雉形瓶中, 加人适量稀硫酸, 充分反应后, 加蒸馏水稀释至 $250 ~mL$, 取 $25.00 ~mL$, 加人足量 $KI$ 溶液, 滴几滴淀粉溶液, 用 $0.1000 ~mol · L^{-1} Na_{2} ~S_{2} O_{3}$ 溶液滴定至终点, 消耗滴定液 $20.00 ~mL$ 。该产品纯度为
648/m
\%(用含 $m$ 的代数式表示)。若加人硫酸过多, 会导致测得结果偏高
(填“偏高”“偏低”或“无影响”)。已知: 有关滴定反应为 $2 Cu^{2+}+4 I^{-}=2 CuI \downarrow+I_{2}, I_{2}+2 ~S_{2} O_{3}^{2-}=2 I^{-}+S_{4} O_{6}^{2-}$ 。 $S_{2} O_{3}^{2-}+2 H^{+}=SO_{2} \uparrow+2 ~S \downarrow+H_{2} O$ 。
答案:
(1)具支试管 吸收尾气中的$NH_{3}$和水,防止其影响$SO_{2}$的漂白性实验
(2)过滤 减小$NH_{4}CuSO_{3}$的溶解度,减小损失
(3)$H_{2}O$
(4)$2NH_{4}CuSO_{3}+4H^{+}=2NH_{4}^{+}+Cu^{2+}+Cu+2SO_{2}\uparrow +2H_{2}O$
(5)$\frac {648}{m}$ 偏高
(1)具支试管 吸收尾气中的$NH_{3}$和水,防止其影响$SO_{2}$的漂白性实验
(2)过滤 减小$NH_{4}CuSO_{3}$的溶解度,减小损失
(3)$H_{2}O$
(4)$2NH_{4}CuSO_{3}+4H^{+}=2NH_{4}^{+}+Cu^{2+}+Cu+2SO_{2}\uparrow +2H_{2}O$
(5)$\frac {648}{m}$ 偏高
17. (14 分) 为了去除合成氨原料气中的 $CO_{2}$ 以降低能耗及减轻设备的酸蚀, 工业上常采用醇胺溶液进行吸收。 $N$ -甲基二乙醇胺 (用 $MDEA$ 表示) 水溶液具有吸收能力强、对设备腐蚀小、可再生等特点被广泛应用。
$MDEA$ 吸收 $CO_{2}$ 的反应可以表示为:
$MDEA(aq)+CO_{2}(~g)+H_{2} O(l) \rightleftharpoons MDEAH^{+}(aq)+HCO_{3}^{-}(aq)$ $\Delta H$
该反应分以下两步进行:
(1) $CO_{2}(~g)+H_{2} O(l) \rightleftharpoons H_{2} CO_{3}(aq)$ $\Delta H_{1}=-20.4 ~kJ · mol^{-1}$ (慢反应)
(2) $MDEA(aq)+H_{2} CO_{3}(aq) \rightleftharpoons MDEAH^{+}(aq)+HCO_{3}^{-}(aq)$ $\Delta H_{2}=-35.5 ~kJ · mol^{-1}$ (快反应)
(1) $\Delta H=$
(2) $MDEA$ 的结构简式为 $(HOCH_{2} CH_{2})_{2} NCH_{3}$, 以氮原子为中心的 VSEPR 模型是
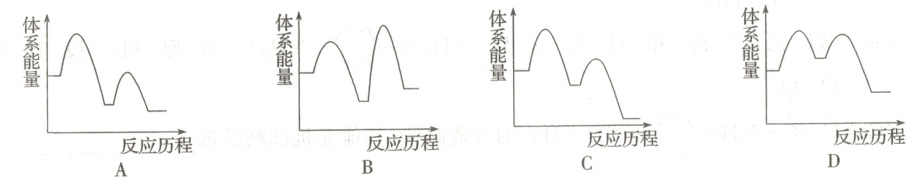
(3) 能够正确表示 $MDEA$ 吸收 $CO_{2}$ 反应能量变化的是
(4) 其他条件不变时, 加人 $MDEA$
(5) 已知 $MDEA$ 中的氮具有一元碱 (类似于 $NH_{3}$ ) 的性质, $K_{b}=5.2 × 10^{-4}$, 已知 $H_{2} CO_{3}$ 的 $K_{a 1}=4.3 × 10^{-7}, K_{a 2}=5.6 × 10^{-11}$, 则 $MDEAHHCO_{3}$ 溶液中 $c(MDEAH^{+})$
(6) 标准平衡常数 $K^{\ominus}$ 可以表示平衡时各物质的浓度关系: 如反应 $A(aq)+2 ~B(~g) \rightleftharpoons C(g)+D(aq)$ 的 $K^{\ominus}=\frac{\frac{p(C)}{p^{\ominus}} × \frac{c(D)}{c^{\ominus}}}{\frac{c(A)}{c^{\ominus}} ×(\frac{p(B)}{p^{\ominus}})^{2}}$, 其中 $c^{\ominus}=1 ~mol · L^{-1}, p^{\ominus}$ 为标准大气压, $p(~B) 、 p(C)$ 分别为气体的分压, $c$ 为物质的量浓度。在 $T^{\circ} C$ 时的刚性密闭容器中, 用 $20 ~L 2.3 ~mol · L^{-1}$ 的 $MDEA$ 溶液吸收总压为 $p^{\ominus} kPa$ 的合成氨原料气 (含体积分数分别为 $30 \%$ 的 $N_{2} 、 55 \%$ 的 $H_{2} 、 15 \%$ 的 $CO_{2}$ ), 充分吸收后, $MDEA$ 浓度降低为 $2.0 ~mol · L^{-1}$, 二氧化碳的吸收率为 $60 \%$, 忽略反应过程中溶液的体积变化, 则反应的标准平衡常数 $K^{\ominus}=$
$MDEA$ 吸收 $CO_{2}$ 的反应可以表示为:
$MDEA(aq)+CO_{2}(~g)+H_{2} O(l) \rightleftharpoons MDEAH^{+}(aq)+HCO_{3}^{-}(aq)$ $\Delta H$
该反应分以下两步进行:
(1) $CO_{2}(~g)+H_{2} O(l) \rightleftharpoons H_{2} CO_{3}(aq)$ $\Delta H_{1}=-20.4 ~kJ · mol^{-1}$ (慢反应)
(2) $MDEA(aq)+H_{2} CO_{3}(aq) \rightleftharpoons MDEAH^{+}(aq)+HCO_{3}^{-}(aq)$ $\Delta H_{2}=-35.5 ~kJ · mol^{-1}$ (快反应)
(1) $\Delta H=$
−55.9
$kJ · mol^{-1}$, 该反应在低温
(填“高温”“低温”或“任意温度”) 条件下自发进行。(2) $MDEA$ 的结构简式为 $(HOCH_{2} CH_{2})_{2} NCH_{3}$, 以氮原子为中心的 VSEPR 模型是
四面体形
。(3) 能够正确表示 $MDEA$ 吸收 $CO_{2}$ 反应能量变化的是
C
(填字母)。
(4) 其他条件不变时, 加人 $MDEA$
不能
(填“能”或“不能”) 增大单位时间内 $CO_{2}$ 的吸收率。(5) 已知 $MDEA$ 中的氮具有一元碱 (类似于 $NH_{3}$ ) 的性质, $K_{b}=5.2 × 10^{-4}$, 已知 $H_{2} CO_{3}$ 的 $K_{a 1}=4.3 × 10^{-7}, K_{a 2}=5.6 × 10^{-11}$, 则 $MDEAHHCO_{3}$ 溶液中 $c(MDEAH^{+})$
>
(填“>”“=”或“<”) $c(HCO_{3}^{-})$ 。(6) 标准平衡常数 $K^{\ominus}$ 可以表示平衡时各物质的浓度关系: 如反应 $A(aq)+2 ~B(~g) \rightleftharpoons C(g)+D(aq)$ 的 $K^{\ominus}=\frac{\frac{p(C)}{p^{\ominus}} × \frac{c(D)}{c^{\ominus}}}{\frac{c(A)}{c^{\ominus}} ×(\frac{p(B)}{p^{\ominus}})^{2}}$, 其中 $c^{\ominus}=1 ~mol · L^{-1}, p^{\ominus}$ 为标准大气压, $p(~B) 、 p(C)$ 分别为气体的分压, $c$ 为物质的量浓度。在 $T^{\circ} C$ 时的刚性密闭容器中, 用 $20 ~L 2.3 ~mol · L^{-1}$ 的 $MDEA$ 溶液吸收总压为 $p^{\ominus} kPa$ 的合成氨原料气 (含体积分数分别为 $30 \%$ 的 $N_{2} 、 55 \%$ 的 $H_{2} 、 15 \%$ 的 $CO_{2}$ ), 充分吸收后, $MDEA$ 浓度降低为 $2.0 ~mol · L^{-1}$, 二氧化碳的吸收率为 $60 \%$, 忽略反应过程中溶液的体积变化, 则反应的标准平衡常数 $K^{\ominus}=$
0.75
。
答案:
(1)−55.9 低温
(2)四面体形
(3)C
(4)不能
(5)>
(6)0.75
(1)−55.9 低温
(2)四面体形
(3)C
(4)不能
(5)>
(6)0.75
查看更多完整答案,请扫码查看


