2026年薪火金卷高考仿真模拟卷化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年薪火金卷高考仿真模拟卷化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
15. (16分)精脱硫技术主要用于煤气中羰基硫(COS)和二硫化碳($CS_{2}$)的转化。回答下列问题:
(1)利用焦炉煤气中的$H_{2}$可脱除煤气中羰基硫(COS)。羰基硫氢化反应历程有途径Ⅰ和途径Ⅱ两种可能,如图所示:
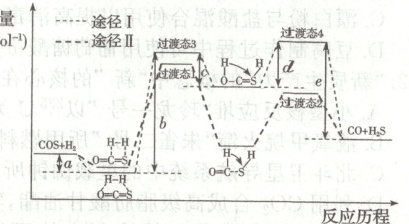
①已知羰基硫氢化反应速率较快,推测其更合理的反应历程是途径
②反应$COS$(g)+$H_{2}$(g)$\xlongequal{}$$CO$(g)+$H_{2}S$(g)的$\Delta H=$
(2)$MoS_{2}$可作羰基硫氢化反应的催化剂,催化机理如图甲所示:
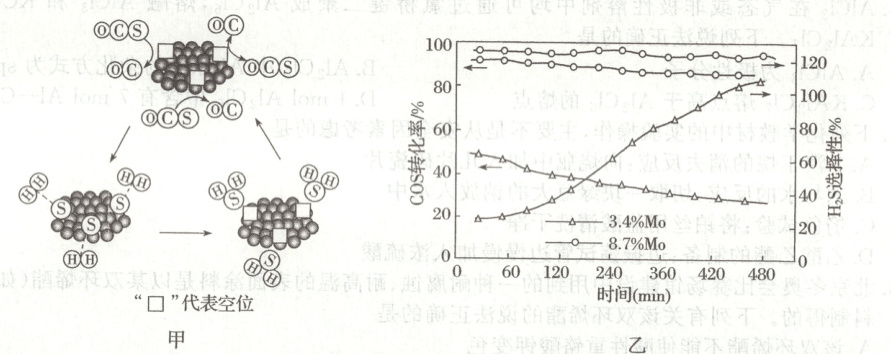
不同钼(Mo)含量的$MoS_{2}$催化剂对COS转化率和$H_{2}S$的选择性不同,实验数据如图乙所示。根据图中数据,选择

(3)金属Mo的晶胞如图所示,若原子a、b的坐标分别为(0,0,0)、(1,0,0),则原子c的坐标为
(4)一定温度下,向恒容密闭容器中充入物质的量之比为1:4的$CS_{2}$(g)和$H_{2}$(g),发生反应$CS_{2}$(g)+4$H_{2}$(g)${<=>[][]}$$CH_{4}$(g)+2$H_{2}S$(g),容器内气体压强随时间变化如下表所示。

①0~250 min内,$H_{2}$分压的平均变化值为
②该温度下,平衡常数$K_{p}=$
(1)利用焦炉煤气中的$H_{2}$可脱除煤气中羰基硫(COS)。羰基硫氢化反应历程有途径Ⅰ和途径Ⅱ两种可能,如图所示:

①已知羰基硫氢化反应速率较快,推测其更合理的反应历程是途径
Ⅱ
(填“Ⅰ”或“Ⅱ”)。②反应$COS$(g)+$H_{2}$(g)$\xlongequal{}$$CO$(g)+$H_{2}S$(g)的$\Delta H=$
b - a - c + d - e
$kJ·mol^{-1}$。(2)$MoS_{2}$可作羰基硫氢化反应的催化剂,催化机理如图甲所示:

不同钼(Mo)含量的$MoS_{2}$催化剂对COS转化率和$H_{2}S$的选择性不同,实验数据如图乙所示。根据图中数据,选择
8.7%Mo
(填“3.4%Mo”或“8.7%Mo”)作催化剂效果最好;当$H_{2}S$选择性低于100%时表明部分COS气体与催化剂发生了反应,催化剂有吸硫现象,若$H_{2}S$选择性高于100%,可能的原因是催化剂本身在反应过程中有失硫现象
。
(3)金属Mo的晶胞如图所示,若原子a、b的坐标分别为(0,0,0)、(1,0,0),则原子c的坐标为
(1/2,1/2,1)
,设晶体密度为$\rho\ g·cm^{-3}$,则晶胞参数为$\sqrt[3]{\frac{384}{\rho N_{A}}}× 10^{10}$
pm(阿伏加德罗常数的值为$N_{A}$)。(4)一定温度下,向恒容密闭容器中充入物质的量之比为1:4的$CS_{2}$(g)和$H_{2}$(g),发生反应$CS_{2}$(g)+4$H_{2}$(g)${<=>[][]}$$CH_{4}$(g)+2$H_{2}S$(g),容器内气体压强随时间变化如下表所示。

①0~250 min内,$H_{2}$分压的平均变化值为
0.28
$kPa·min^{-1}$。②该温度下,平衡常数$K_{p}=$
$\frac{17.5×(17.5× 2)^{2}}{(20 - 17.5)×(80 - 17.5× 4)^{4}}\ (kPa)^{-2} = \frac{17.5× 35^{2}}{2.5× 10^{4}}$
($kPa$)$^{-2}$(列出计算式)。
答案:
15. 解析
(1)①反应的活化能越大,反应速率越慢,由图可知,途径Ⅰ的活化能大于途径Ⅱ,反应速率慢于途径Ⅱ,所以反应速率较快的羰基硫化的反应历程是途径Ⅱ。
②由图可知,该反应为反应物总能量小于生成物总能量的吸热反应,反应的$\Delta H = (b - a - c)\ kJ·mol^{-1} - (e - d)\ kJ·mol^{-1} = (b - a - c + d - e)\ kJ·mol^{-1}$。
(2)由图可知,时间相同时,$8.7\%\ Mo$作催化剂条件下反应的羰基硫转化率和硫化氢选择性均大于$3.4\%\ Mo$作催化剂条件下,说明反应速率快于$3.4\%\ Mo$作催化剂条件下,所以选择$8.7\%\ Mo$作催化剂效果最好;由题意可知,硫化氢选择性低于 100%是因为部分羰基硫气体与催化剂发生了反应,催化剂有吸硫现象所致,则硫化氢选择性高于 100%是因为催化剂本身在反应过程中有失硫现象所致。
(3)由晶胞结构可知,晶胞中位于顶点的原子 a、b 的坐标分别为$(0,0,0)$、$(1,0,0)$,则晶胞的边长为 1,所以位于面心的原子 c 的坐标为$(\frac{1}{2},\frac{1}{2},1)$;位于顶点和面心的钼原子个数为$8×\frac{1}{8} + 6×\frac{1}{2} = 4$,设晶胞参数为$a\ pm$,由晶胞的质量公式可得:$\frac{4× 96}{N_{A}} = 10^{-30}a\rho$,解得$a = \sqrt[3]{\frac{384}{\rho N_{A}}}× 10^{10}$。
(4)由表格数据可知,起始二硫化碳、氢气的分压分别为$100\ kPa×\frac{1}{5} = 20\ kPa$、$100\ kPa - 20\ kPa = 80\ kPa$,$250\ min$反应达到平衡时,容器内气体压强为$65\ kPa$,设平衡时消耗二硫化碳的分压为$a\ kPa$,由题意可建立如下三段式:
${CS_{2}(g) + 4H_{2}(g)⇌ CH_{4}(g) + 2H_{2}S(g)}$
起始/$kPa$ 20 80 0 0
转化/$kPa$ $a$ $4a$ $a$ $2a$
平衡/$kPa$ $20 - a$ $80 - 4a$ $a$ $2a$
由平衡时容器内气体压强为$65\ kPa$可得:$100 - 2a = 65$,解得$a = 17.5$;
①由三段式所得数据可知,$0\sim 250\ min$内,氢气分压的平均变化值为$\frac{17.5\ kPa× 4}{250\ min} = 0.28\ kPa/min$;
②由三段式所得数据可知,该温度下,平衡常数$K_{p} = \frac{17.5\ kPa×(17.5\ kPa× 2)^{2}}{(20\ kPa - 17.5\ kPa)×(80\ kPa - 17.5\ kPa× 4)^{4}} = \frac{17.5× 35^{2}}{2.5× 10^{4}}\ (kPa)^{-2}$。
答案
(1)①Ⅱ ②$b - a - c + d - e$
(2)$8.7\%\ Mo$ 催化剂本身在反应过程中有失硫现象
(3)$(\frac{1}{2},\frac{1}{2},1)$ $\sqrt[3]{\frac{384}{\rho N_{A}}}× 10^{10}$
(4)①$0.28$
②$\frac{17.5×(17.5× 2)^{2}}{(20 - 17.5)×(80 - 17.5× 4)^{4}}\ (kPa)^{-2} = \frac{17.5× 35^{2}}{2.5× 10^{4}}$
(1)①反应的活化能越大,反应速率越慢,由图可知,途径Ⅰ的活化能大于途径Ⅱ,反应速率慢于途径Ⅱ,所以反应速率较快的羰基硫化的反应历程是途径Ⅱ。
②由图可知,该反应为反应物总能量小于生成物总能量的吸热反应,反应的$\Delta H = (b - a - c)\ kJ·mol^{-1} - (e - d)\ kJ·mol^{-1} = (b - a - c + d - e)\ kJ·mol^{-1}$。
(2)由图可知,时间相同时,$8.7\%\ Mo$作催化剂条件下反应的羰基硫转化率和硫化氢选择性均大于$3.4\%\ Mo$作催化剂条件下,说明反应速率快于$3.4\%\ Mo$作催化剂条件下,所以选择$8.7\%\ Mo$作催化剂效果最好;由题意可知,硫化氢选择性低于 100%是因为部分羰基硫气体与催化剂发生了反应,催化剂有吸硫现象所致,则硫化氢选择性高于 100%是因为催化剂本身在反应过程中有失硫现象所致。
(3)由晶胞结构可知,晶胞中位于顶点的原子 a、b 的坐标分别为$(0,0,0)$、$(1,0,0)$,则晶胞的边长为 1,所以位于面心的原子 c 的坐标为$(\frac{1}{2},\frac{1}{2},1)$;位于顶点和面心的钼原子个数为$8×\frac{1}{8} + 6×\frac{1}{2} = 4$,设晶胞参数为$a\ pm$,由晶胞的质量公式可得:$\frac{4× 96}{N_{A}} = 10^{-30}a\rho$,解得$a = \sqrt[3]{\frac{384}{\rho N_{A}}}× 10^{10}$。
(4)由表格数据可知,起始二硫化碳、氢气的分压分别为$100\ kPa×\frac{1}{5} = 20\ kPa$、$100\ kPa - 20\ kPa = 80\ kPa$,$250\ min$反应达到平衡时,容器内气体压强为$65\ kPa$,设平衡时消耗二硫化碳的分压为$a\ kPa$,由题意可建立如下三段式:
${CS_{2}(g) + 4H_{2}(g)⇌ CH_{4}(g) + 2H_{2}S(g)}$
起始/$kPa$ 20 80 0 0
转化/$kPa$ $a$ $4a$ $a$ $2a$
平衡/$kPa$ $20 - a$ $80 - 4a$ $a$ $2a$
由平衡时容器内气体压强为$65\ kPa$可得:$100 - 2a = 65$,解得$a = 17.5$;
①由三段式所得数据可知,$0\sim 250\ min$内,氢气分压的平均变化值为$\frac{17.5\ kPa× 4}{250\ min} = 0.28\ kPa/min$;
②由三段式所得数据可知,该温度下,平衡常数$K_{p} = \frac{17.5\ kPa×(17.5\ kPa× 2)^{2}}{(20\ kPa - 17.5\ kPa)×(80\ kPa - 17.5\ kPa× 4)^{4}} = \frac{17.5× 35^{2}}{2.5× 10^{4}}\ (kPa)^{-2}$。
答案
(1)①Ⅱ ②$b - a - c + d - e$
(2)$8.7\%\ Mo$ 催化剂本身在反应过程中有失硫现象
(3)$(\frac{1}{2},\frac{1}{2},1)$ $\sqrt[3]{\frac{384}{\rho N_{A}}}× 10^{10}$
(4)①$0.28$
②$\frac{17.5×(17.5× 2)^{2}}{(20 - 17.5)×(80 - 17.5× 4)^{4}}\ (kPa)^{-2} = \frac{17.5× 35^{2}}{2.5× 10^{4}}$
查看更多完整答案,请扫码查看


