2025年非常学案高中化学选择性必修第一册人教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年非常学案高中化学选择性必修第一册人教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第78页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
1. 判断正误(正确的打“√”,错误的打“×”)。
(1) 用$50mL$碱式滴定管可准确量取$25.00mLKMnO_{4}$溶液。(
(2) 一支标有“$20℃、25mL$”字样的滴定管内装液体到刻度$1.00mL$时,管内液体的体积大于$24.00mL$。(
(3) 中和滴定实验中,锥形瓶用蒸馏水洗净后即可使用,滴定管用蒸馏水洗净后,必须润洗后方可使用。(
(4) 滴定管盛标准溶液时,调液面一定要调到“0”刻度。(
(5) 当观察到锥形瓶中颜色发生变化,立即停止滴定并记下滴定管液面读数。(
(6) 中和反应的终点就是中和点,此时溶液呈中性。(
(1) 用$50mL$碱式滴定管可准确量取$25.00mLKMnO_{4}$溶液。(
×
)(2) 一支标有“$20℃、25mL$”字样的滴定管内装液体到刻度$1.00mL$时,管内液体的体积大于$24.00mL$。(
√
)(3) 中和滴定实验中,锥形瓶用蒸馏水洗净后即可使用,滴定管用蒸馏水洗净后,必须润洗后方可使用。(
√
)(4) 滴定管盛标准溶液时,调液面一定要调到“0”刻度。(
×
)(5) 当观察到锥形瓶中颜色发生变化,立即停止滴定并记下滴定管液面读数。(
×
)(6) 中和反应的终点就是中和点,此时溶液呈中性。(
×
)
答案:
1.
(1)×
(2)√
(3)√
(4)×
(5)×
(6)×
(1)×
(2)√
(3)√
(4)×
(5)×
(6)×
2. 用酸碱中和滴定法测定某烧碱样品的纯度,试根据实验回答下列问题:
(1) 准确称量$8.2g$含有少量中性易溶杂质的样品,配成$500mL$待测溶液。称量时,样品可放在
A. 小烧杯中
B. 洁净纸片上
C. 托盘上
(2) 滴定时,用$0.2000mol· L^{-1}$的盐酸来滴定待测溶液,不可选用
A. 甲基橙
B. 石蕊
C. 酚酞
(3) 滴定过程中,眼睛应注视
(4) 若用酚酞溶液作指示剂,滴定终点判断方法为______________________。
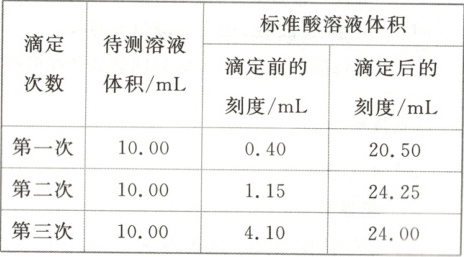
(5) 根据下表数据,计算被测烧碱溶液的物质的量浓度是
(1) 准确称量$8.2g$含有少量中性易溶杂质的样品,配成$500mL$待测溶液。称量时,样品可放在
A
(填字母,下同)称量。A. 小烧杯中
B. 洁净纸片上
C. 托盘上
(2) 滴定时,用$0.2000mol· L^{-1}$的盐酸来滴定待测溶液,不可选用
B
作指示剂。A. 甲基橙
B. 石蕊
C. 酚酞
(3) 滴定过程中,眼睛应注视
锥形瓶内溶液颜色的变化
;在锥形瓶下垫一张白纸,其目的是便于观察锥形瓶内液体颜色的变化,减小滴定误差
。(4) 若用酚酞溶液作指示剂,滴定终点判断方法为______________________。
(5) 根据下表数据,计算被测烧碱溶液的物质的量浓度是
0.400 0
$mol· L^{-1}$,烧碱样品的纯度是97.56%
(保留四位有效数字)。
答案:
解析:
(5)$V_{1}=20.10\ mL$,$V_{2}=23.10\ mL$,$V_{3}=19.90\ mL$,第二次数据差别大,舍去,故$\overline{V}=20.00\ mL$。根据$c{(HCl)}· V{[HCl(aq)]}=c{(NaOH)}· V{[NaOH(aq)]}$得$0.200\ 0\ mol·L^{-1}×20.00\ mL=c{(NaOH)}×10.00\ mL$,$c{(NaOH)}=0.400\ 0\ mol·L^{-1}$,$w{(NaOH)}=\frac{0.400\ 0\ mol·L^{-1}×0.5\ L×40\ g·mol^{-1}}{8.2\ g}×100\%=97.56\%$。
答案:
(1)A
(2)B
(3)锥形瓶内溶液颜色的变化 便于观察锥形瓶内液体颜色的变化,减小滴定误差
(4)当滴入最后半滴盐酸时,溶液由浅红色变为无色,且半分钟内不变色
(5)$0.400\ 0$ $97.56\%$
(5)$V_{1}=20.10\ mL$,$V_{2}=23.10\ mL$,$V_{3}=19.90\ mL$,第二次数据差别大,舍去,故$\overline{V}=20.00\ mL$。根据$c{(HCl)}· V{[HCl(aq)]}=c{(NaOH)}· V{[NaOH(aq)]}$得$0.200\ 0\ mol·L^{-1}×20.00\ mL=c{(NaOH)}×10.00\ mL$,$c{(NaOH)}=0.400\ 0\ mol·L^{-1}$,$w{(NaOH)}=\frac{0.400\ 0\ mol·L^{-1}×0.5\ L×40\ g·mol^{-1}}{8.2\ g}×100\%=97.56\%$。
答案:
(1)A
(2)B
(3)锥形瓶内溶液颜色的变化 便于观察锥形瓶内液体颜色的变化,减小滴定误差
(4)当滴入最后半滴盐酸时,溶液由浅红色变为无色,且半分钟内不变色
(5)$0.400\ 0$ $97.56\%$
3. 请回答有关滴定过程中的相关问题。
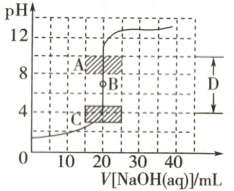
(1) 用已知浓度的氢氧化钠溶液滴定未知浓度的盐酸,滴定曲线如图所示。
在图中A的pH范围使用的指示剂是________;C的pH范围使用的指示剂是_________。
(2) 如图表示用相同浓度的$NaOH$溶液分别滴定浓度相同的3种一元酸,由图可确定酸性最强的是________。


(1) 用已知浓度的氢氧化钠溶液滴定未知浓度的盐酸,滴定曲线如图所示。
在图中A的pH范围使用的指示剂是________;C的pH范围使用的指示剂是_________。
(2) 如图表示用相同浓度的$NaOH$溶液分别滴定浓度相同的3种一元酸,由图可确定酸性最强的是________。

答案:
3.
(1)酚酞 甲基橙
(2)③
(1)酚酞 甲基橙
(2)③
新知必备
1. 分析依据
依据公式来判断。和在误差分析时是定值,因此只需分析使消耗标准液体积变大或变小的原因即可,变大,则偏高,变小,则偏低。
2. 常见的误差分析
(1) 以用标准盐酸滴定待测氢氧化钠溶液为例:

(2) 在进行误差分析时,要特别注意俯视(视线偏高)及仰视(视线偏低)的含义,并会区分俯视、仰视对量筒、滴定管产生误差的不同(如图)。

下列图示读数对滴定结果的影响如下:

①如图Ⅰ,开始仰视读数,滴定完毕俯视读数,滴定结果会偏小。
②如图Ⅱ,开始俯视读数,滴定完毕仰视读数,滴定结果会偏大。
1. 分析依据
依据公式来判断。和在误差分析时是定值,因此只需分析使消耗标准液体积变大或变小的原因即可,变大,则偏高,变小,则偏低。
2. 常见的误差分析
(1) 以用标准盐酸滴定待测氢氧化钠溶液为例:

(2) 在进行误差分析时,要特别注意俯视(视线偏高)及仰视(视线偏低)的含义,并会区分俯视、仰视对量筒、滴定管产生误差的不同(如图)。

下列图示读数对滴定结果的影响如下:

①如图Ⅰ,开始仰视读数,滴定完毕俯视读数,滴定结果会偏小。
②如图Ⅱ,开始俯视读数,滴定完毕仰视读数,滴定结果会偏大。
答案:
2.
(1)变大 偏高 变小 偏低 变大 偏高 不变 无影响
变小 偏低 变大 偏高 变小 偏低 变大 偏高 变大 偏高 变小 偏低 变大 偏高
(1)变大 偏高 变小 偏低 变大 偏高 不变 无影响
变小 偏低 变大 偏高 变小 偏低 变大 偏高 变大 偏高 变小 偏低 变大 偏高
查看更多完整答案,请扫码查看


