2025年非常学案高中化学选择性必修第一册人教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年非常学案高中化学选择性必修第一册人教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第56页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
2. 对密闭容器中进行的反应:$X(g) + 3Y(g) \rightleftharpoons 2Z(g)$,根据相关实验数据绘制了如图所示的图像,下列说法错误的是(

A.依据图甲可判断正反应为放热反应
B.在图乙中,虚线可表示使用了催化剂后$X$的转化率
C.图丙可表示减小压强,平衡向逆反应方向移动
D.依据图丁中混合气体的平均相对分子质量随温度的变化情况,可推知正反应的$\Delta H < 0$
C
)
A.依据图甲可判断正反应为放热反应
B.在图乙中,虚线可表示使用了催化剂后$X$的转化率
C.图丙可表示减小压强,平衡向逆反应方向移动
D.依据图丁中混合气体的平均相对分子质量随温度的变化情况,可推知正反应的$\Delta H < 0$
答案:
2. C [依据图像分析,温度升高时逆反应速率大于正反应速率,平衡逆向进行,则逆反应是吸热反应,正反应是放热反应,A正确;使用催化剂化学反应速率增大,可缩短反应达到平衡的时间,化学平衡不移动,X的转化率不变,B正确;正反应是气体体积缩小的反应,减小压强使平衡逆向移动,则$ v_{正} < v_{逆} $,但减小压强化学反应速率减小,故$ v_{正} $、$ v_{逆} $均减小,C错误;温度升高平均相对分子质量减小,由于气体总质量不变,则气体总物质的量变大,平衡逆向移动,说明逆反应是吸热反应,正反应是放热反应,即$ \Delta H < 0 $,D正确。]
3. 在恒压、$NO$和$O_2$的起始浓度一定的条件下,催化反应相同时间,测得不同温度下$NO$转化为$NO_2$的转化率如图中实线所示(图中虚线表示相同条件下$NO$的平衡转化率随温度的变化)。下列说法正确的是(
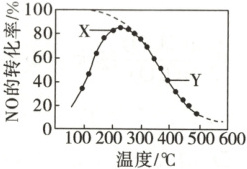
A.反应$2NO(g) + O_2(g) \rightleftharpoons 2NO_2(g)$的$\Delta H > 0$
B.图中$X$点所示条件下,延长反应时间不能提高$NO$的转化率
C.图中$Y$点所示条件下,增加$O_2$的浓度不能提高$NO$的转化率
D.$380\ ^{\circ}C$下,$c_{起始}(O_2) = 5.0 × 10^{-4}\ mol · L^{-1}$,$NO$的平衡转化率为$50\%$,则平衡常数$K > 2000$
D
)
A.反应$2NO(g) + O_2(g) \rightleftharpoons 2NO_2(g)$的$\Delta H > 0$
B.图中$X$点所示条件下,延长反应时间不能提高$NO$的转化率
C.图中$Y$点所示条件下,增加$O_2$的浓度不能提高$NO$的转化率
D.$380\ ^{\circ}C$下,$c_{起始}(O_2) = 5.0 × 10^{-4}\ mol · L^{-1}$,$NO$的平衡转化率为$50\%$,则平衡常数$K > 2000$
答案:
3. D [由虚线可知,随温度升高,NO的平衡转化率逐渐降低,说明平衡逆向移动,则NO与$ {O_2} $生成$ {NO_2} $的反应为放热反应,$ \Delta H < 0 $,A项错误;图像中实线的最高点为平衡点,X点未达到平衡,延长时间反应继续向右进行,NO的转化率增大,B项错误;Y点为平衡点,增大$ {O_2} $的浓度,平衡正向移动,可以提高NO的转化率,C项错误;设NO起始浓度为$ a \, mol · L^{-1} $,NO的转化率为50%,则平衡时NO、$ {O_2} $和$ {NO_2} $的浓度分别为$ 0.5a \, mol · L^{-1} $、$ (5 × 10^{-4} - 0.25a) \, mol · L^{-1} $、$ 0.5a \, mol · L^{-1} $,该反应的平衡常数$ K = \frac{c^2({NO_2})}{c^2({NO}) · c({O_2})} = \frac{1}{5 × 10^{-4} - 0.25a} > \frac{1}{5 × 10^{-4}} = 2000 $,D项正确。]
4. 钛铁矿提炼钛的反应之一为$4Fe_2TiO_5(s) + 4TiO_2(s) + CH_4(g) \rightleftharpoons 8FeTiO_3(s) + CO_2(g) + 2H_2O(g)$,该反应的平衡常数的负对数($-lg K$)随温度($T$)的变化曲线如图所示,下列说法正确的是(

①该反应为放热反应
②$d$点时反应的平衡常数$K = 10^{-3.56}$
③恒容容器中混合气体的平均相对分子质量保持不变,该反应达到平衡状态
④$X$点时$v_正 > v_逆$
A.①②
B.②④
C.②③
D.③④
C
)
①该反应为放热反应
②$d$点时反应的平衡常数$K = 10^{-3.56}$
③恒容容器中混合气体的平均相对分子质量保持不变,该反应达到平衡状态
④$X$点时$v_正 > v_逆$
A.①②
B.②④
C.②③
D.③④
答案:
4. C [结合图示可知,温度升高,$ -\lg K $减小,即温度升高,平衡常数增大,说明升高温度平衡正向移动,该反应为吸热反应,①错误;结合图示可知,d点时$ -\lg K = 3.56 $,该反应的平衡常数$ K = 10^{-3.56} $,②正确;假设该反应未达平衡,反应正向进行,混合气体的平均相对分子质量会增大,现恒容容器中混合气体的平均相对分子质量保持不变,能说明该反应达到平衡状态,③正确;X点时,反应未达到平衡,最终要达到平衡状态,平衡常数的负对数要变大,所以此时的$ -\lg Q < -\lg K $,则$ Q > K $,此时的反应状态为$ v_{正} < v_{逆} $,④错误,故选C。]
【实验目的】
1. 认识浓度、温度等因素对化学平衡的影响。
2. 进一步学习控制变量、对比等科学方法。
【实验用品】
小烧杯、大烧杯、量筒、试管、试管架、玻璃棒、
胶头滴管、酒精灯、火柴、两个封装有$NO_2$和$N_2O_4$混合气体的圆底烧瓶。
铁粉、$0.05\ mol· L^{-1}\ FeCl_3$溶液、$0.15\ mol· L^{-1}KSCN$溶液、$0.1\ mol· L^{-1}\ K_2Cr_2O_7$溶液、$6\ mol· L^{-1}NaOH$溶液、$6\ mol· L^{-1}\ H_2SO_4$溶液、$0.5\ mol· L^{-1}CuCl_2$溶液、热水、冰块、蒸馏水。
【实验步骤】
一、浓度对化学平衡的影响
1.$FeCl_3$溶液与$KSCN$溶液的反应

2. 在$K_2Cr_2O_7$溶液中存在如下平衡:$Cr_2O_7^{2-}+H_2O\rightleftharpoons2CrO_4^{2-}+2H^+$(橙色)(黄色)

二、温度对化学平衡的影响
1. 在$CuCl_2$溶液中存在如下平衡:$[Cu(H_2O)_4]^{2+}+4Cl^-\rightleftharpoons[CuCl_4]^{2-}+4H_2O$
(蓝色)(黄色)
$\Delta H>0$

2. 取两个封装有$NO_2$和$N_2O_4$混合气体的圆底烧瓶(编号分别为1和2)。$NO_2$和$N_2O_4$存在如下平衡:$2NO_2(g)\rightleftharpoons N_2O_4(g)\ \ \ \Delta H<0$。

【问题和讨论】
1. 在进行浓度、温度对化学平衡影响的实验时,应注意哪些问题?
2. 结合实验内容,尝试归纳影响化学平衡移动的因素。
3. 在对$CuCl_2$溶液加热时,你是否观察到了$[CuCl_4]^{2-}$的黄色?你能说出原因吗?
1. 认识浓度、温度等因素对化学平衡的影响。
2. 进一步学习控制变量、对比等科学方法。
【实验用品】
小烧杯、大烧杯、量筒、试管、试管架、玻璃棒、
胶头滴管、酒精灯、火柴、两个封装有$NO_2$和$N_2O_4$混合气体的圆底烧瓶。
铁粉、$0.05\ mol· L^{-1}\ FeCl_3$溶液、$0.15\ mol· L^{-1}KSCN$溶液、$0.1\ mol· L^{-1}\ K_2Cr_2O_7$溶液、$6\ mol· L^{-1}NaOH$溶液、$6\ mol· L^{-1}\ H_2SO_4$溶液、$0.5\ mol· L^{-1}CuCl_2$溶液、热水、冰块、蒸馏水。
【实验步骤】
一、浓度对化学平衡的影响
1.$FeCl_3$溶液与$KSCN$溶液的反应

2. 在$K_2Cr_2O_7$溶液中存在如下平衡:$Cr_2O_7^{2-}+H_2O\rightleftharpoons2CrO_4^{2-}+2H^+$(橙色)(黄色)

二、温度对化学平衡的影响
1. 在$CuCl_2$溶液中存在如下平衡:$[Cu(H_2O)_4]^{2+}+4Cl^-\rightleftharpoons[CuCl_4]^{2-}+4H_2O$
(蓝色)(黄色)
$\Delta H>0$

2. 取两个封装有$NO_2$和$N_2O_4$混合气体的圆底烧瓶(编号分别为1和2)。$NO_2$和$N_2O_4$存在如下平衡:$2NO_2(g)\rightleftharpoons N_2O_4(g)\ \ \ \Delta H<0$。

【问题和讨论】
1. 在进行浓度、温度对化学平衡影响的实验时,应注意哪些问题?
2. 结合实验内容,尝试归纳影响化学平衡移动的因素。
3. 在对$CuCl_2$溶液加热时,你是否观察到了$[CuCl_4]^{2-}$的黄色?你能说出原因吗?
答案:
[实验步骤]
一、1.加深 加深 正反应方向 变浅 变浅 逆反应方向
2.加深 正向 加深 逆向
二、1.蓝 绿色 正向 恢复蓝色 逆向 2.加深 变浅
变浅 加深 正向 逆向
[问题和讨论]
1.注意控制变量法的运用,在研究温度对平衡移动的影响时,
只能改变温度这一个条件,其他条件保持一致。还要注意对
比法的运用。
2.浓度改变:增加反应物的浓度,减少生成物的浓度,平衡向正
反应方向移动;减少反应物的浓度,增加生成物的浓度,平衡
向逆反应方向移动。
温度改变:升高温度,平衡向吸热反应方向移动;降低温度,
平衡向放热反应方向移动。
3.在对${CuCl_{2}}$溶液加热时,不能观察到${[CuCl_{4}]^{2-}}$的黄色。因
为加热时,平衡正向移动,${[Cu(H_{2}O)_{4}]^{2+}}$有部分转化为
${[CuCl_{4}]^{2-}}$,${[Cu(H_{2}O)_{4}]^{2+}}$显蓝色,${[CuCl_{4}]^{2-}}$显黄色,二者
的混合色为绿色,所以看不到黄色。
一、1.加深 加深 正反应方向 变浅 变浅 逆反应方向
2.加深 正向 加深 逆向
二、1.蓝 绿色 正向 恢复蓝色 逆向 2.加深 变浅
变浅 加深 正向 逆向
[问题和讨论]
1.注意控制变量法的运用,在研究温度对平衡移动的影响时,
只能改变温度这一个条件,其他条件保持一致。还要注意对
比法的运用。
2.浓度改变:增加反应物的浓度,减少生成物的浓度,平衡向正
反应方向移动;减少反应物的浓度,增加生成物的浓度,平衡
向逆反应方向移动。
温度改变:升高温度,平衡向吸热反应方向移动;降低温度,
平衡向放热反应方向移动。
3.在对${CuCl_{2}}$溶液加热时,不能观察到${[CuCl_{4}]^{2-}}$的黄色。因
为加热时,平衡正向移动,${[Cu(H_{2}O)_{4}]^{2+}}$有部分转化为
${[CuCl_{4}]^{2-}}$,${[Cu(H_{2}O)_{4}]^{2+}}$显蓝色,${[CuCl_{4}]^{2-}}$显黄色,二者
的混合色为绿色,所以看不到黄色。
查看更多完整答案,请扫码查看


