2025年非常学案高中化学选择性必修第一册人教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年非常学案高中化学选择性必修第一册人教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第60页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
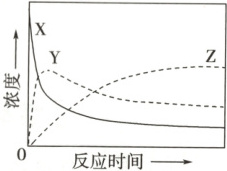
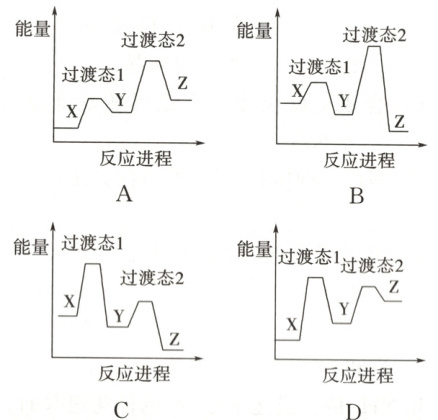
1.(2024·安徽卷)某温度下,在密闭容器中充入一定量的$X(g)$,发生下列反应:$X(g)\rightleftharpoons Y(g)\ (\Delta H_1<0)$,$Y(g)\rightleftharpoons Z(g)\ (\Delta H_2<0)$,测得各气体浓度与反应时间的关系如图所示。下列反应进程示意图符合题意的是
(

(
B
)
答案:
1. B [由图可知,反应初期随着时间的推移X的浓度逐渐减小、Y和Z的浓度逐渐增大,后来随着时间的推移X和Y的浓度逐渐减小、Z的浓度继续逐渐增大,说明${X(g)⇌ Y(g)}$的反应速率大于${Y(g)⇌ Z(g)}$的反应速率,则反应${X(g)⇌ Y(g)}$的活化能小于反应${Y(g)⇌ Z(g)}$的活化能。${X(g)⇌ Y(g)}$和${Y(g)⇌ Z(g)}$的$\Delta H$都小于0,而图像显示,${X(g)⇌ Y(g)}$和${Y(g)⇌ Z(g)}$的$\Delta H$都大于0,A项不符合题意;图像显示${X(g)⇌ Y(g)}$和${Y(g)⇌ Z(g)}$的$\Delta H$都小于0,且${X(g)⇌ Y(g)}$的活化能小于${Y(g)⇌ Z(g)}$的活化能,B项符合题意;图像显示${X(g)⇌ Y(g)}$和${Y(g)⇌ Z(g)}$的$\Delta H$都小于0,但图像上${X(g)⇌ Y(g)}$的活化能大于${Y(g)⇌ Z(g)}$的活化能,C项不符合题意;图像显示${X(g)⇌ Y(g)}$和${Y(g)⇌ Z(g)}$的$\Delta H$都大于0,且${X(g)⇌ Y(g)}$的活化能大于${Y(g)⇌ Z(g)}$的活化能,D项不符合题意。]
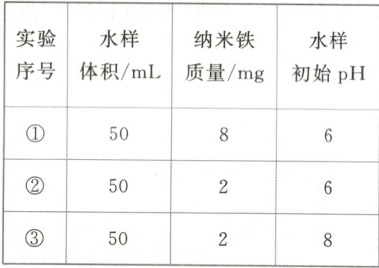
2.(2024·安徽卷)室温下,为探究纳米铁去除水样中$SeO^{2-}_{4}$的影响因素,测得不同条件下$SeO^{2-}_{4}$浓度随时间变化关系如下图。
下列说法正确的是
(
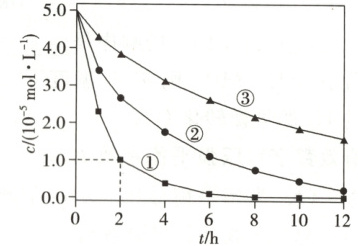
A.实验①中,$0\sim2$小时内平均反应速率$v(SeO^{2-}_{4})=2.0\ mol· L^{-1}·h^{-1}$
B.实验③中,反应的离子方程式为$2Fe+SeO^{2-}_{4}+8H^{+}\longrightarrow2Fe^{3+}+Se+4H_{2}O$
C.其他条件相同时,适当增加纳米铁质量可加快反应速率
D.其他条件相同时,水样初始pH越小,$SeO^{2-}_{4}$的去除效果越好
下列说法正确的是
(
C
)

A.实验①中,$0\sim2$小时内平均反应速率$v(SeO^{2-}_{4})=2.0\ mol· L^{-1}·h^{-1}$
B.实验③中,反应的离子方程式为$2Fe+SeO^{2-}_{4}+8H^{+}\longrightarrow2Fe^{3+}+Se+4H_{2}O$
C.其他条件相同时,适当增加纳米铁质量可加快反应速率
D.其他条件相同时,水样初始pH越小,$SeO^{2-}_{4}$的去除效果越好
答案:
2. C [实验①中,$0\sim 2$小时内平均反应速率$v{(SeO^{2-}_{4})}= \dfrac{(5.0× 10^{-5}-1.0× 10^{-5})\ \mathrm{mol· L^{-1}}}{2\ \mathrm{h}}=2.0× 10^{-5}\ \mathrm{mol· L^{-1}}· \mathrm{h}^{-1}$,A不正确;实验③中水样初始${pH}=8$,溶液显弱碱性,发生反应的离子方程式中不能用${H^{+}}$配电荷守恒,B不正确;综合分析实验①和②可知,在相同时间内,实验①中${SeO^{2-}_{4}}$浓度的变化量大,因此,其他条件相同时,适当增加纳米铁的质量可加快反应速率,C正确;综合分析实验③和②可知,在相同时间内,实验②中${SeO^{2-}_{4}}$浓度的变化量大,因此,其他条件相同时,适当减小初始${pH}$,${SeO^{2-}_{4}}$的去除效果越好,但是当初始${pH}$太小时,${H^{+}}$浓度太大,纳米铁与${H^{+}}$反应速率加快,会导致与${SeO^{2-}_{4}}$反应的纳米铁减少,因此,当初始${pH}$越小时${SeO^{2-}_{4}}$的去除效果不一定越好,D不正确。]
3.(2024·黑吉辽卷)异山梨醇是一种由生物质制备的高附加值化学品;$150\ {^{\circ}C}$时其制备过程及相关物质浓度随时间变化如图所示,$15\ {h}$后异山梨醇浓度不再变化。下列说法错误的是
(
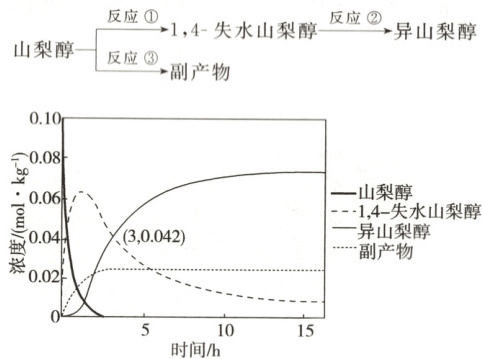
A.$3\ {h}$时,反应②正、逆反应速率相等
B.该温度下的平衡常数:①>②
C.$0\sim3\ {h}$平均速率$v(异山梨醇)=0.014\ mol· kg^{-1}·h^{-1}$
D.反应②加入催化剂不改变其平衡转化率
(
A
)
A.$3\ {h}$时,反应②正、逆反应速率相等
B.该温度下的平衡常数:①>②
C.$0\sim3\ {h}$平均速率$v(异山梨醇)=0.014\ mol· kg^{-1}·h^{-1}$
D.反应②加入催化剂不改变其平衡转化率
答案:
3. A [由图可知,3小时后异山梨醇浓度继续增大,15 h后异山梨醇浓度才不再变化,所以3 h时,反应②未达到平衡状态,即正、逆反应速率不相等,故A错误;图像显示该温度下,15 h后所有物质浓度都不再变化,且此时山梨醇转化完全,即反应充分,而1,4-失水山梨醇仍有剩余,即反应②正向进行程度小于反应①、反应限度小于反应①,所以该温度下的平衡常数:①$>$②,故B正确;由图可知,在$0\sim 3\ \mathrm{h}$内异山梨醇的浓度变化量为$0.042\ \mathrm{mol· kg^{-1}}$,所以平均速率$v(异山梨醇)=\dfrac{0.042\ \mathrm{mol· kg^{-1}}}{3\ \mathrm{h}}=0.014\ \mathrm{mol· kg^{-1}· h^{-1}}$,故C正确;催化剂只能改变化学反应速率,不能改变物质平衡转化率,所以反应②加入催化剂不改变其平衡转化率,故D正确。]
4.(2024·山东卷,改编)逆水气变换反应:$CO_{2}(g)+H_{2}(g)\rightleftharpoonsCO(g)+H_{2}O(g)\ \ \Delta H>0$。
一定压力下,按$CO_{2}、H_{2}$物质的量之比$n(CO_{2}):n(H_{2}) = 1:1$投料,$T_1、T_2$温度时反应物摩尔分数随时间变化关系如图所示。已知该反应的速率方程为$v = kc^{0.5}(H_{2})c(CO_{2})$,$T_1、T_2$温度时反应速率常数$k$分别为$k_1、k_2$。下列说法正确的是
(
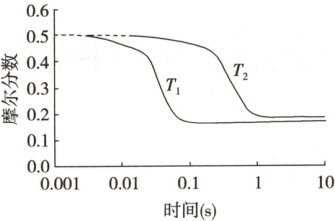
A.$k_1<k_2$
B.$T_1、T_2$温度下达平衡时反应速率的比值:$\frac{v(T_1)}{v(T_2)}<\frac{k_1}{k_2}$
C.温度不变,仅改变体系初始压力,反应物摩尔分数随时间的变化曲线不变
D.$T_2$温度下,改变初始投料比例,可使平衡时各组分摩尔分数与$T_1$温度时相同
一定压力下,按$CO_{2}、H_{2}$物质的量之比$n(CO_{2}):n(H_{2}) = 1:1$投料,$T_1、T_2$温度时反应物摩尔分数随时间变化关系如图所示。已知该反应的速率方程为$v = kc^{0.5}(H_{2})c(CO_{2})$,$T_1、T_2$温度时反应速率常数$k$分别为$k_1、k_2$。下列说法正确的是
(
B
)
A.$k_1<k_2$
B.$T_1、T_2$温度下达平衡时反应速率的比值:$\frac{v(T_1)}{v(T_2)}<\frac{k_1}{k_2}$
C.温度不变,仅改变体系初始压力,反应物摩尔分数随时间的变化曲线不变
D.$T_2$温度下,改变初始投料比例,可使平衡时各组分摩尔分数与$T_1$温度时相同
答案:
4. B [由图可知,$T_{1}$比$T_{2}$反应速率大,则$T_{1}>T_{2}$;$T_{1}$温度下达到平衡时反应物的摩尔分数低于$T_{2}$温度下平衡时反应物的摩尔分数;由于起始${CO_{2}}$与${H_{2}}$的物质的量之比为$1:1$,则达到平衡时${CO_{2}}$和${H_{2}}$的摩尔分数相等。
根据分析,$T_{1}$比$T_{2}$反应速率大,反应速率常数与温度有关,结合反应速率方程知$k_{1}>k_{2}$,A项错误;反应的速率方程为$v=kc^{0.5}{(H_{2})}c{(CO_{2})}$,则$\dfrac{v(T_{1})}{v(T_{2})}=\dfrac{k_{1}c^{0.5}_{1}{(H_{2})}c_{1}{(CO_{2})}}{k_{2}c^{0.5}_{2}{(H_{2})}c_{2}{(CO_{2})}}$,$T_{1}$温度下达到平衡时反应物的摩尔分数低于$T_{2}$温度下平衡时反应物的摩尔分数,则$\dfrac{v(T_{1})}{v(T_{2})}<\dfrac{k_{1}}{k_{2}}$,B项正确;温度不变,仅改变体系初始压力,虽然平衡不移动,但反应物的浓度改变,反应速率改变,反应达到平衡的时间改变,反应物摩尔分数随时间的变化曲线变化,C项错误;$T_{2}$温度下,改变初始投料比,相当于改变某一反应物的浓度,达到平衡时${H_{2}}$和${CO_{2}}$的摩尔分数不可能相等,故不能使平衡时各组分摩尔分数与$T_{1}$温度时相同,D项错误。]
根据分析,$T_{1}$比$T_{2}$反应速率大,反应速率常数与温度有关,结合反应速率方程知$k_{1}>k_{2}$,A项错误;反应的速率方程为$v=kc^{0.5}{(H_{2})}c{(CO_{2})}$,则$\dfrac{v(T_{1})}{v(T_{2})}=\dfrac{k_{1}c^{0.5}_{1}{(H_{2})}c_{1}{(CO_{2})}}{k_{2}c^{0.5}_{2}{(H_{2})}c_{2}{(CO_{2})}}$,$T_{1}$温度下达到平衡时反应物的摩尔分数低于$T_{2}$温度下平衡时反应物的摩尔分数,则$\dfrac{v(T_{1})}{v(T_{2})}<\dfrac{k_{1}}{k_{2}}$,B项正确;温度不变,仅改变体系初始压力,虽然平衡不移动,但反应物的浓度改变,反应速率改变,反应达到平衡的时间改变,反应物摩尔分数随时间的变化曲线变化,C项错误;$T_{2}$温度下,改变初始投料比,相当于改变某一反应物的浓度,达到平衡时${H_{2}}$和${CO_{2}}$的摩尔分数不可能相等,故不能使平衡时各组分摩尔分数与$T_{1}$温度时相同,D项错误。]
查看更多完整答案,请扫码查看


