2025年非常学案高中化学选择性必修第一册人教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年非常学案高中化学选择性必修第一册人教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第6页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
1. 判断下列热化学方程式的正误,错误的指明原因。
(1)$2\mathrm{NO_2}\longrightarrow\mathrm{O_2}+2\mathrm{NO}\ \ \Delta H=+116.2\ kJ·mol^{-1}$
(2)$3.2\ g\ \mathrm{CH_4}$完全燃烧生成$\mathrm{CO_2}(g)$和$\mathrm{H_2O}(l)$时放出$178\ kJ$的热量,其热化学方程式为$\mathrm{CH_4}(g)+2\mathrm{O_2}(g)\longrightarrow\mathrm{CO_2}(g)+2\mathrm{H_2O}(l)\$
(3)已知$\mathrm{N_2}(g)+3\mathrm{H_2}(g)⇌2\mathrm{NH_3}(g)\ \ \Delta H=-92\ kJ·mol^{-1}$,则$\mathrm{NH_3}(g)⇌\frac{1}{2}\mathrm{N_2}(g)+\frac{3}{2}\mathrm{H_2}(g)\ \ \Delta H=+46\ kJ·mol^{-1}$ (
(4)$2\ mol\ \mathrm{HgO}$分解生成液态汞和氧气时,吸收$181.4\ kJ$的热量,$\mathrm{HgO}(s)\longrightarrow\mathrm{Hg}(l)+\frac{1}{2}\mathrm{O_2}(g)\ \ \Delta H=-90.7\ kJ·mol^{-1}$ (
(1)$2\mathrm{NO_2}\longrightarrow\mathrm{O_2}+2\mathrm{NO}\ \ \Delta H=+116.2\ kJ·mol^{-1}$
物质未标明聚集状态
(×
)。(2)$3.2\ g\ \mathrm{CH_4}$完全燃烧生成$\mathrm{CO_2}(g)$和$\mathrm{H_2O}(l)$时放出$178\ kJ$的热量,其热化学方程式为$\mathrm{CH_4}(g)+2\mathrm{O_2}(g)\longrightarrow\mathrm{CO_2}(g)+2\mathrm{H_2O}(l)\$
数值正确,单位应为kJ·mol⁻¹
$\ \Delta H=-890\ kJ$ (×
)。(3)已知$\mathrm{N_2}(g)+3\mathrm{H_2}(g)⇌2\mathrm{NH_3}(g)\ \ \Delta H=-92\ kJ·mol^{-1}$,则$\mathrm{NH_3}(g)⇌\frac{1}{2}\mathrm{N_2}(g)+\frac{3}{2}\mathrm{H_2}(g)\ \ \Delta H=+46\ kJ·mol^{-1}$ (
√
)。(4)$2\ mol\ \mathrm{HgO}$分解生成液态汞和氧气时,吸收$181.4\ kJ$的热量,$\mathrm{HgO}(s)\longrightarrow\mathrm{Hg}(l)+\frac{1}{2}\mathrm{O_2}(g)\ \ \Delta H=-90.7\ kJ·mol^{-1}$ (
该反应吸热,$\Delta H$应为“+”值
)。
答案:
(1)× 物质未标明聚集状态
(2)× 数值正确,单位应为kJ·mol⁻¹
(3)√
(4)× 该反应吸热,$\Delta H$应为“+”值
(1)× 物质未标明聚集状态
(2)× 数值正确,单位应为kJ·mol⁻¹
(3)√
(4)× 该反应吸热,$\Delta H$应为“+”值
2. 反应物$\mathrm{X}$生成$\mathrm{Z}$的能量变化
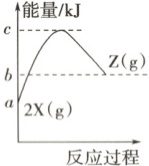
该反应的热化学方程式为 (
A.$2\mathrm{X}(g)\longrightarrow\mathrm{Z}(g)\ \ \Delta H = -(a - b)\ kJ·mol^{-1}$
B.$2\mathrm{X}(g)\longrightarrow\mathrm{Z}(g)\ \ \Delta H=-(b - a)\ kJ·mol^{-1}$
C.$2\mathrm{X}(g)\longrightarrow\mathrm{Z}(g)\ \ \Delta H=-(c - a)\ kJ·mol^{-1}$
D.$2\mathrm{X}(g)\longrightarrow\mathrm{Z}(g)\ \ \Delta H=-(b - c)\ kJ·mol^{-1}$

该反应的热化学方程式为 (
A
)A.$2\mathrm{X}(g)\longrightarrow\mathrm{Z}(g)\ \ \Delta H = -(a - b)\ kJ·mol^{-1}$
B.$2\mathrm{X}(g)\longrightarrow\mathrm{Z}(g)\ \ \Delta H=-(b - a)\ kJ·mol^{-1}$
C.$2\mathrm{X}(g)\longrightarrow\mathrm{Z}(g)\ \ \Delta H=-(c - a)\ kJ·mol^{-1}$
D.$2\mathrm{X}(g)\longrightarrow\mathrm{Z}(g)\ \ \Delta H=-(b - c)\ kJ·mol^{-1}$
答案:
2.A [由题图可知,反应物X生成Z为吸热反应,吸收的热量即为$(b - a)\ kJ$,所以该反应的热化学方程式为$2{X(g)} \to {Z(g)}$ $\Delta H = -(a - b)\ kJ·mol^{-1}$,故A正确。]
3. 根据所给信息,书写对应的热化学方程式。
(1)已知$1\ mol\ \mathrm{C}(s$,石墨$)$与适量$\mathrm{H_2O}(g)$反应生成$\mathrm{CO}(g)$和$\mathrm{H_2}(g)$,吸收$131.3\ kJ$热量,请写出该反应的热化学方程式:
(2)$1.7\ g\ \mathrm{NH_3}(g)$发生催化氧化反应生成气态产物,放出$22.67\ kJ$热量,其热化学方程式:
(3)已知:$\mathrm{N_2}(g)+3\mathrm{H_2}(g)⇌2\mathrm{NH_3}(g)\ \ \Delta H = -92\ kJ·mol^{-1}$,请写出$1\ mol\ \mathrm{NH_3}$分解对应的热化学方程式:
若$1\ mol\ \mathrm{N_2}(g)$和$3\ mol\ \mathrm{H_2}(g)$在一定条件下发生反应,放出的热量
(1)已知$1\ mol\ \mathrm{C}(s$,石墨$)$与适量$\mathrm{H_2O}(g)$反应生成$\mathrm{CO}(g)$和$\mathrm{H_2}(g)$,吸收$131.3\ kJ$热量,请写出该反应的热化学方程式:
${C(s, 石墨) + H_{2}O(g) = CO(g) + H_{2}(g)}$ $\Delta H = +131.3\ kJ·mol^{-1}$
。(2)$1.7\ g\ \mathrm{NH_3}(g)$发生催化氧化反应生成气态产物,放出$22.67\ kJ$热量,其热化学方程式:
${NH_{3}(g) + \frac{5}{4}O_{2}(g) = NO(g) + \frac{3}{2}H_{2}O(g)}$ $\Delta H = -226.7\ kJ·mol^{-1}$
。(3)已知:$\mathrm{N_2}(g)+3\mathrm{H_2}(g)⇌2\mathrm{NH_3}(g)\ \ \Delta H = -92\ kJ·mol^{-1}$,请写出$1\ mol\ \mathrm{NH_3}$分解对应的热化学方程式:
${NH_{3}(g) ⇌ \frac{1}{2}N_{2}(g) + \frac{3}{2}H_{2}(g)}$ $\Delta H = +46\ kJ·mol^{-1}$
。若$1\ mol\ \mathrm{N_2}(g)$和$3\ mol\ \mathrm{H_2}(g)$在一定条件下发生反应,放出的热量
小于
(填“大于”“小于”或“等于”)$92\ kJ$,理由是该反应是可逆反应,不能进行完全
。
答案:
3.
(1)${C(s, 石墨) + H_{2}O(g) = CO(g) + H_{2}(g)}$ $\Delta H = +131.3\ kJ·mol^{-1}$
(2)${NH_{3}(g) + \frac{5}{4}O_{2}(g) = NO(g) + \frac{3}{2}H_{2}O(g)}$ $\Delta H = -226.7\ kJ·mol^{-1}$
(3)${NH_{3}(g) ⇌ \frac{1}{2}N_{2}(g) + \frac{3}{2}H_{2}(g)}$ $\Delta H = +46\ kJ·mol^{-1}$ 小于 该反应是可逆反应,不能进行完全
(1)${C(s, 石墨) + H_{2}O(g) = CO(g) + H_{2}(g)}$ $\Delta H = +131.3\ kJ·mol^{-1}$
(2)${NH_{3}(g) + \frac{5}{4}O_{2}(g) = NO(g) + \frac{3}{2}H_{2}O(g)}$ $\Delta H = -226.7\ kJ·mol^{-1}$
(3)${NH_{3}(g) ⇌ \frac{1}{2}N_{2}(g) + \frac{3}{2}H_{2}(g)}$ $\Delta H = +46\ kJ·mol^{-1}$ 小于 该反应是可逆反应,不能进行完全
查看更多完整答案,请扫码查看


