2025年非常学案高中化学选择性必修第一册人教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年非常学案高中化学选择性必修第一册人教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第69页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
1. 常温下,将 $0.1 mol · L^{-1}\ HNO_2$ 溶液加水稀释至 $0.01 mol · L^{-1}$ 的过程中,下列说法不正确的是 (
A.$HNO_2$ 的电离常数表达式为 $K_a = \frac{c(NO_2^-) · c(H^+)}{c(HNO_2)}$
B.稀释过程中,$K_a(HNO_2)$ 保持不变
C.稀释过程中,$HNO_2$ 溶液中的粒子种类保持不变
D.稀释过程中 $\frac{c(NO_2^-)}{c(HNO_2)}$ 变小
D
)A.$HNO_2$ 的电离常数表达式为 $K_a = \frac{c(NO_2^-) · c(H^+)}{c(HNO_2)}$
B.稀释过程中,$K_a(HNO_2)$ 保持不变
C.稀释过程中,$HNO_2$ 溶液中的粒子种类保持不变
D.稀释过程中 $\frac{c(NO_2^-)}{c(HNO_2)}$ 变小
答案:
D [$\dfrac {c{(NO^{-}_{2})}}{c{(HNO_{2})}}=\dfrac {c{(NO^{-}_{2})}· c{(H^{+})}}{c{(HNO_{2})}· c{(H^{+})}}=\dfrac {K_{a}}{c{(H^{+})}}$,加水稀释$c{(H^{+})}$减小,$K_{a}$不变,$\dfrac {c{(NO^{-}_{2})}}{c{(HNO_{2})}}$变大,D错误。]
2. $25°C$ 时,$0.1 mol · L^{-1}$ 某一元酸 $HA$ 的电离平衡常数约为 $1 × 10^{-7}$,下列叙述不正确的是 (
A.该溶液中的 $c(H^+) = 1 × 10^{-4} mol · L^{-1}$
B.此溶液中,$HA$ 约有 $0.1\%$ 发生电离
C.$0.1 mol · L^{-1}\ HA$ 溶液与 $c(H^+) = 1 × 10^{-4} mol · L^{-1}$ 的盐酸等体积混合,$HA$ 的电离平衡正向移动
D.加水稀释到体积为原来的2倍,溶液中的 $c(H^+)$ 大于原来的 $\frac{1}{2}$
C
)A.该溶液中的 $c(H^+) = 1 × 10^{-4} mol · L^{-1}$
B.此溶液中,$HA$ 约有 $0.1\%$ 发生电离
C.$0.1 mol · L^{-1}\ HA$ 溶液与 $c(H^+) = 1 × 10^{-4} mol · L^{-1}$ 的盐酸等体积混合,$HA$ 的电离平衡正向移动
D.加水稀释到体积为原来的2倍,溶液中的 $c(H^+)$ 大于原来的 $\frac{1}{2}$
答案:
C [$0.1\ {mol· L^{-1}}{HA}$溶液中$c{(H^{+})}=1× 10^{-4}\ {mol· L^{-1}}$,与$c{(H^{+})}=1× 10^{-4}\ {mol· L^{-1}}$盐酸中$c{(H^{+})}$相等,故等体积混合,${HA}$的电离平衡不移动,C错误。]
3. (教材互鉴:改编自苏教版教材)相同温度下,根据三种酸的电离常数,下列判断正确的是 (
酸 $HCN$ $CH_3COOH$ $H_3PO_2$
电离常数 $K_a$ $6.2 × 10^{-10}$ $1.75 × 10^{-5}$ $5.9 × 10^{-2}$

A.三种酸的强弱关系:$HCN > CH_3COOH > H_3PO_2$
B.反应 $H_3PO_2 + CH_3COO^- \longrightarrow CH_3COOH + H_2PO_2^-$ 能够发生
C.由电离常数可以判断,$H_3PO_2$ 属于强酸,$HCN$ 和 $CH_3COOH$ 属于弱酸
D.相同温度下,$1 mol · L^{-1}\ HCN$ 溶液的电离常数大于 $0.1 mol · L^{-1}\ HCN$ 溶液的电离常数
B
)酸 $HCN$ $CH_3COOH$ $H_3PO_2$
电离常数 $K_a$ $6.2 × 10^{-10}$ $1.75 × 10^{-5}$ $5.9 × 10^{-2}$

A.三种酸的强弱关系:$HCN > CH_3COOH > H_3PO_2$
B.反应 $H_3PO_2 + CH_3COO^- \longrightarrow CH_3COOH + H_2PO_2^-$ 能够发生
C.由电离常数可以判断,$H_3PO_2$ 属于强酸,$HCN$ 和 $CH_3COOH$ 属于弱酸
D.相同温度下,$1 mol · L^{-1}\ HCN$ 溶液的电离常数大于 $0.1 mol · L^{-1}\ HCN$ 溶液的电离常数
答案:
B [相同温度下,酸性越强,电离常数越大,三种酸的强弱关系:${HCN}<{CH_{3}COOH}<{H_{3}PO_{2}}$,故A错误;根据“强酸制弱酸”,反应${H_{3}PO_{2} + CH_{3}COO^{-}\xlongequal{}CH_{3}COOH + H_{2}PO^{-}_{2}}$能够发生,故B正确;由电离常数可以判断,${H_{3}PO_{2}}$、${HCN}$、${CH_{3}COOH}$都属于弱酸,故C错误;电离常数与浓度无关,相同温度下,$1\ {mol· L^{-1}}\ {HCN}$溶液的电离常数等于$0.1\ {mol· L^{-1}}\ {HCN}$溶液的电离常数,故D错误。]
4. $25°C$ 时,$CH_3COOH、H_2CO_3$ 和 $HClO$ 的电离平衡常数如下:
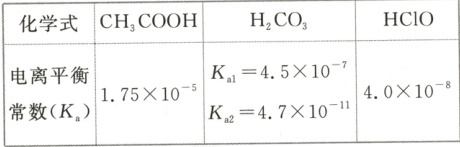
化学式 $CH_3COOH$ $H_2CO_3$ $HClO$
电离平衡常数($K_a$) $1.75 × 10^{-5}$
$K_a1 = 4.5 × 10^{-7}$
$K_a2 = 4.7 × 10^{-11}$ $4.0 × 10^{-8}$
(1) $25°C$ 时,等物质的量浓度的 $HClO$ 溶液和 $CH_3COOH$ 溶液中 $c(H^+)$ 关系为 $HClO$ 溶液
(2) 下列化学反应能发生的是
A. $HClO + CH_3COONa \longrightarrow CH_3COOH + NaClO$
B. $CH_3COOH + Na_2CO_3 \longrightarrow NaHCO_3 + CH_3COONa$
C. $CO_2 + H_2O + 2NaClO \longrightarrow Na_2CO_3 + 2HClO$
(3) $25°C$,$0.01 mol · L^{-1}$ 的 $HClO$ 溶液中 $c(H^+)$ 约为

化学式 $CH_3COOH$ $H_2CO_3$ $HClO$
电离平衡常数($K_a$) $1.75 × 10^{-5}$
$K_a1 = 4.5 × 10^{-7}$
$K_a2 = 4.7 × 10^{-11}$ $4.0 × 10^{-8}$
(1) $25°C$ 时,等物质的量浓度的 $HClO$ 溶液和 $CH_3COOH$ 溶液中 $c(H^+)$ 关系为 $HClO$ 溶液
<
(填“>”“<”或“=”) $CH_3COOH$ 溶液。(2) 下列化学反应能发生的是
B
(填字母)。A. $HClO + CH_3COONa \longrightarrow CH_3COOH + NaClO$
B. $CH_3COOH + Na_2CO_3 \longrightarrow NaHCO_3 + CH_3COONa$
C. $CO_2 + H_2O + 2NaClO \longrightarrow Na_2CO_3 + 2HClO$
(3) $25°C$,$0.01 mol · L^{-1}$ 的 $HClO$ 溶液中 $c(H^+)$ 约为
2×10^{-5}
$mol · L^{-1}$。
答案:
解析:
(1)$25\ ^{\circ}C$时,$K_{a}{(HClO)}\lt K_{a}{(CH_{3}COOH)}$,则酸性:${HClO}<{CH_{3}COOH}$,故等物质的量浓度时,${CH_{3}COOH}$的电离程度大,电离产生的$c{(H^{+})}$大于${HClO}$溶液。
(2)相同条件下,电离常数越大,对应酸的酸性越强,结合表中数据可知,酸性:${CH_{3}COOH}>{H_{2}CO_{3}}>{HClO}>{HCO^{-}_{3}}$,根据“较强酸制取较弱酸”的复分解反应规律,${HClO}$与${CH_{3}COONa}$不发生反应,A错误;${CH_{3}COOH}$与${Na_{2}CO_{3}}$溶液反应生成${NaHCO_{3}}$和${CH_{3}COONa}$,B正确;由于${HClO}$的酸性强于${HCO^{-}_{3}}$,故${CO_{2}}$通入${NaClO}$溶液中,无论${CO_{2}}$是否过量,反应均生成${NaHCO_{3}}$和${HClO}$,C错误。
(3)$K_{a}=\dfrac {c{(H^{+})}· c{(ClO^{-})}}{c{(HClO)}}=\dfrac {c^{2}{(H^{+})}}{0.01}=4.0× 10^{-8}$
故$c{(H^{+})}=2× 10^{-5}\ {mol· L^{-1}}$。
答案:
(1)$\boldsymbol{<}$
(2)B
(3)$\boldsymbol{2× 10^{-5}}$
(1)$25\ ^{\circ}C$时,$K_{a}{(HClO)}\lt K_{a}{(CH_{3}COOH)}$,则酸性:${HClO}<{CH_{3}COOH}$,故等物质的量浓度时,${CH_{3}COOH}$的电离程度大,电离产生的$c{(H^{+})}$大于${HClO}$溶液。
(2)相同条件下,电离常数越大,对应酸的酸性越强,结合表中数据可知,酸性:${CH_{3}COOH}>{H_{2}CO_{3}}>{HClO}>{HCO^{-}_{3}}$,根据“较强酸制取较弱酸”的复分解反应规律,${HClO}$与${CH_{3}COONa}$不发生反应,A错误;${CH_{3}COOH}$与${Na_{2}CO_{3}}$溶液反应生成${NaHCO_{3}}$和${CH_{3}COONa}$,B正确;由于${HClO}$的酸性强于${HCO^{-}_{3}}$,故${CO_{2}}$通入${NaClO}$溶液中,无论${CO_{2}}$是否过量,反应均生成${NaHCO_{3}}$和${HClO}$,C错误。
(3)$K_{a}=\dfrac {c{(H^{+})}· c{(ClO^{-})}}{c{(HClO)}}=\dfrac {c^{2}{(H^{+})}}{0.01}=4.0× 10^{-8}$
故$c{(H^{+})}=2× 10^{-5}\ {mol· L^{-1}}$。
答案:
(1)$\boldsymbol{<}$
(2)B
(3)$\boldsymbol{2× 10^{-5}}$
查看更多完整答案,请扫码查看


