第96页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
|类型 1 氢气质量与反应时间曲线$^3⁰$考
|类型|等量金属足量酸|等量酸足量金属|

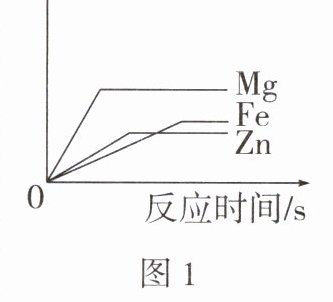
|操作|向等质量镁、锌、铁的粉末中分别加入过量的相同浓度的稀盐酸|向相同浓度相同体积的稀盐酸中分别加入过量且等量的镁、锌、铁粉末|
|图像|||
|分析|横坐标为反应时间时,金属活动性越强,反应速率越快。三种金属与酸的反应速率由快到慢的顺序是
|类型|等量金属足量酸|等量酸足量金属|


|操作|向等质量镁、锌、铁的粉末中分别加入过量的相同浓度的稀盐酸|向相同浓度相同体积的稀盐酸中分别加入过量且等量的镁、锌、铁粉末|
|图像|||
|分析|横坐标为反应时间时,金属活动性越强,反应速率越快。三种金属与酸的反应速率由快到慢的顺序是
Mg>Zn>Fe
(填化学式,后同)。平台高低表示金属与酸反应产生氢气质量的多少,平台越高,反应产生氢气的质量越多
(填"多"或"少")。图1:所加酸足量,金属被消耗完,产生氢气的质量由金属决定,且与金属的相对原子质量成反比(金属在化合物中化合价相同)。三种金属生成氢气的质量由大到小的顺序为Mg>Fe>Zn
。图2:所用金属足量,酸被消耗完,产生氢气的质量由酸决定。由于酸的质量相等,因此上述三种金属对应生成氢气的质量关系为Mg=Fe=Zn
。|
答案:
Mg>Zn>Fe 多 Mg>Fe>Zn Mg=Fe=Zn
1. 足量的镁、铁分别和等体积、等浓度的稀硫酸反应,产生氢气质量与反应时间的关系如图所示,下列说法正确的是(

D
)
答案:
D 【解析】由图示曲线可知,曲线的横坐标为反应时间、纵坐标为氢气质量,故该曲线能表示金属与酸反应速率的快慢。t₁s时,镁反应生成氢气的质量大于铁反应生成氢气的质量,即0~t₁s镁反应产生氢气的速率大于铁,A、B错误;t₂s时,镁、铁反应生成的氢气质量相等,根据生成氢气的质量=参加反应的金属质量×$\frac{金属在化合物中的化合价}{金属的相对原子质量}$可知,生成氢气质量相同,且镁、铁在其化合物中均为+2价时,金属的相对原子质量越大,参加反应的金属质量就越大,因此参加反应的镁的质量小于铁,C错误;由反应过程中氢元素质量守恒可知,生成等量的氢气时,消耗稀硫酸质量也相等,D正确。
2. 等质量、等浓度的稀硫酸分别与足量的镁、铁、锌三种金属的粉末反应,下列图像能正确表示产生氢气的质量与反应时间关系的是(
B
)
答案:
B 【解析】等质量、等浓度的稀硫酸分别与足量的镁、铁、锌三种金属粉末反应,由于金属过量,能够置换出硫酸中全部的氢,因此充分反应后放出氢气的质量相等;根据金属活动性强弱关系:镁>锌>铁,活动性越强的金属与酸反应的速率越快,即镁与稀硫酸的反应时间最短,其次是锌,最后是铁,故选B。
3. 将质量、形状相同的锌和铁两种金属,分别加入足量等浓度的稀硫酸中,产生的氢气质量随反应时间的变化关系如图所示。

(1)图中曲线Y代表的金属是
(2)请写出等量金属X、Y与足量等浓度的稀硫酸反应中,最终消耗稀硫酸质量少的金属与稀硫酸反应的化学方程式为
(3)等质量的锌和铁完全反应后,生成氢气的质量比为

(1)图中曲线Y代表的金属是
铁
(填"锌"或"铁"),将其加入稀硫酸中,可观察到的现象为金属表面产生气泡,固体逐渐溶解,溶液由无色变成浅绿色
。(2)请写出等量金属X、Y与足量等浓度的稀硫酸反应中,最终消耗稀硫酸质量少的金属与稀硫酸反应的化学方程式为
Zn+H₂SO₄=ZnSO₄+H₂↑
。(3)等质量的锌和铁完全反应后,生成氢气的质量比为
56:65
。
答案:
(1)铁 金属表面产生气泡,固体逐渐溶解,溶液由无色变成浅绿色
(2)Zn+H₂SO₄=ZnSO₄+H₂↑
(3)56:65
(1)铁 金属表面产生气泡,固体逐渐溶解,溶液由无色变成浅绿色
(2)Zn+H₂SO₄=ZnSO₄+H₂↑
(3)56:65
查看更多完整答案,请扫码查看


