第119页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
1. 对下列相关说法判断正误(正确的打“√”,错误的打“×”)。
(1)面粉放入水中能形成溶液(
(2)长期放置后不会分层的液体一定是溶液(
(3)溶液的溶质只能是固体(
(4)75%的医用酒精溶液中的溶剂是酒精(
(5)碳酸钙和稀盐酸恰好完全反应后的溶液,溶质是碳酸钙,溶剂是稀盐酸(
2. 下列对溶液的说法中正确的是(
A. 溶液中的溶质只能有一种
B. 均一、稳定的无色透明液体不一定是溶液
C. 任何溶液的溶剂都是水,水可以溶解任何物质
D. 溶液倒出一半后,溶质质量分数减小一半
(1)面粉放入水中能形成溶液(
×
)(2)长期放置后不会分层的液体一定是溶液(
×
)(3)溶液的溶质只能是固体(
×
)(4)75%的医用酒精溶液中的溶剂是酒精(
×
)(5)碳酸钙和稀盐酸恰好完全反应后的溶液,溶质是碳酸钙,溶剂是稀盐酸(
×
)2. 下列对溶液的说法中正确的是(
B
)A. 溶液中的溶质只能有一种
B. 均一、稳定的无色透明液体不一定是溶液
C. 任何溶液的溶剂都是水,水可以溶解任何物质
D. 溶液倒出一半后,溶质质量分数减小一半
答案:
1.
(1)×
(2)×
(3)×
(4)×
(5)× 2.B
(1)×
(2)×
(3)×
(4)×
(5)× 2.B
3. 对下列相关说法判断正误。
(1)将适量的硝酸铵固体加入一定量水中,溶液温度明显上升(
(2)氧化钙加入水中形成氧化钙溶液,且溶解时放出热量(
(3)密闭容器内物质溶解时吸热和放热现象通常会引起容器内压强变化。若吸收热量,则会使密闭容器内压强减小;若放出热量,则会使密闭容器内压强增大(
(1)将适量的硝酸铵固体加入一定量水中,溶液温度明显上升(
×
)(2)氧化钙加入水中形成氧化钙溶液,且溶解时放出热量(
×
)(3)密闭容器内物质溶解时吸热和放热现象通常会引起容器内压强变化。若吸收热量,则会使密闭容器内压强减小;若放出热量,则会使密闭容器内压强增大(
√
)
答案:
3.
(1)×
(2)×
(3)√
(1)×
(2)×
(3)√
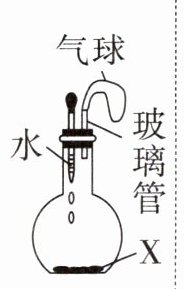
4. 小明同学设计如图所示的模拟实验(装置气密性良好,忽略固体和液体的体积变化),推测气球变化的现象,其中
|实验|物质X|现象推测|
|A|硝酸铵|逐渐变瘪并保持|
|B|铁粉|逐渐变瘪并保持|
|C|生石灰|逐渐胀大慢慢恢复|
|D|氯化钠|基本不变|

不
正
确
的是(A
)|实验|物质X|现象推测|
|A|硝酸铵|逐渐变瘪并保持|
|B|铁粉|逐渐变瘪并保持|
|C|生石灰|逐渐胀大慢慢恢复|
|D|氯化钠|基本不变|


答案:
4.A 【解析】硝酸铵固体溶于水时吸收热量,温度降低,使得装置内气体压强减小,气球变瘪,待温度恢复至室温后,气体压强也恢复到最初的压强,气球慢慢恢复原状,A不正确;铁粉和装置内的氧气、水同时作用发生缓慢氧化而生锈,装置内氧气减少,使得装置内压强减小,气球逐渐变瘪并保持,B正确;生石灰和水反应放出大量的热,使得装置内气体压强变大,待恢复至室温后,气体压强也恢复到最初的压强,气球慢慢恢复原状,C正确;氯化钠溶于水没有明显的热量变化,装置内气体压强没有明显变化,因此气球基本不变,D正确。
5. 对下列相关说法判断正误。
(1)不饱和溶液只能通过降温转化为饱和溶液(
(2)任何物质的饱和溶液降温,都会有晶体析出(
(3)析出晶体后的溶液一定是该物质在该温度下的饱和溶液(
(4)不饱和石灰水通过增加溶质、恒温蒸发溶剂或降低温度的方法均可成为饱和溶液(
(5)饱和溶液一定是该物质的浓溶液,不饱和溶液一定是稀溶液(
(1)不饱和溶液只能通过降温转化为饱和溶液(
×
)(2)任何物质的饱和溶液降温,都会有晶体析出(
×
)(3)析出晶体后的溶液一定是该物质在该温度下的饱和溶液(
√
)(4)不饱和石灰水通过增加溶质、恒温蒸发溶剂或降低温度的方法均可成为饱和溶液(
×
)(5)饱和溶液一定是该物质的浓溶液,不饱和溶液一定是稀溶液(
×
)
答案:
5.
(1)×
(2)×
(3)√
(4)×
(5)×
(1)×
(2)×
(3)√
(4)×
(5)×
6. 对下列相关说法判断正误。
(1)物质的溶解度都随温度的升高而增大(
(2)配制溶液时,搅拌可以增大固体溶质的溶解度(
(3)温度是影响物质溶解度的唯一因素(
(4)将20g硝酸钾放入50g水中,充分搅拌,所得溶液质量一定是70g(
(5)将20g氯化钠放入100g水中,固体全部溶解,所得溶液的溶质质量分数为20%(
(6)某溶液恒温蒸发10g水,析出2g晶体,若再恒温蒸发10g水,析出晶体质量也一定为2g(
(1)物质的溶解度都随温度的升高而增大(
×
)(2)配制溶液时,搅拌可以增大固体溶质的溶解度(
×
)(3)温度是影响物质溶解度的唯一因素(
×
)(4)将20g硝酸钾放入50g水中,充分搅拌,所得溶液质量一定是70g(
×
)(5)将20g氯化钠放入100g水中,固体全部溶解,所得溶液的溶质质量分数为20%(
×
)(6)某溶液恒温蒸发10g水,析出2g晶体,若再恒温蒸发10g水,析出晶体质量也一定为2g(
×
)
答案:
6.
(1)×
(2)×
(3)×
(4)×
(5)×
(6)×
(1)×
(2)×
(3)×
(4)×
(5)×
(6)×
7. 如图为硝酸钾、氯化铵和氯化钠的溶解度随温度的变化曲线。
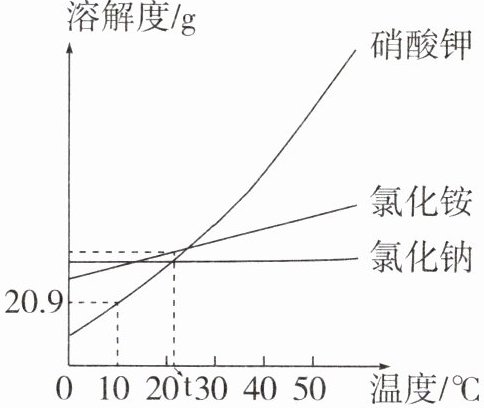
(1)10℃时硝酸钾的溶解度为______
(2)t℃时三种物质的溶解度大小为______
(3)若配制40℃时三种物质的饱和溶液100g,需要加水的质量大小关系:______
(4)将40℃时三种物质的饱和溶液同时降温至t℃,溶质质量分数的大小关系:______
(5)提纯含有少量氯化钠的硝酸钾可采用的方法是______

(1)10℃时硝酸钾的溶解度为______
20.9
g。(2)t℃时三种物质的溶解度大小为______
${NH4Cl}>{NaCl}={KNO3}$
(填化学式,后同)。(3)若配制40℃时三种物质的饱和溶液100g,需要加水的质量大小关系:______
${NaCl}>{NH4Cl}>{KNO3}$
。(4)将40℃时三种物质的饱和溶液同时降温至t℃,溶质质量分数的大小关系:______
${NH4Cl}>{NaCl}={KNO3}$
。(5)提纯含有少量氯化钠的硝酸钾可采用的方法是______
降温结晶(或冷却热的饱和溶液)
。
答案:
7.
(1)20.9
(2)${NH4Cl}>{NaCl}={KNO3}$
(3)${NaCl}>{NH4Cl}>{KNO3}$
(4)${NH4Cl}>{NaCl}={KNO3}$
(5)降温结晶(或冷却热的饱和溶液) 【解析】
(1)分析溶解度曲线图,$10\ {^{\circ}C}$时硝酸钾的溶解度为20.9 g。
(2)分析溶解度曲线图,$t\ {^{\circ}C}$时三种物质溶解度大小关系为氯化铵>氯化钠=硝酸钾。
(3)$40\ {^{\circ}C}$时三种物质溶解度大小关系为硝酸钾>氯化铵>氯化钠,此时配制三种物质的饱和溶液100 g,所需水的质量大小关系为氯化钠>氯化铵>硝酸钾。
(4)三种物质的溶解度均随温度升高而增大,将$40\ {^{\circ}C}$时三种物质的饱和溶液同时降温至$t\ {^{\circ}C}$,均有晶体析出,分别得到$t\ {^{\circ}C}$时三种物质的饱和溶液,根据饱和溶液溶质质量分数公式以及$t\ {^{\circ}C}$时三种物质溶解度大小关系(氯化铵>氯化钠=硝酸钾),可知降温后所得溶液溶质质量分数大小关系为氯化铵>氯化钠=硝酸钾。
(5)氯化钠、硝酸钾的溶解度均随温度升高而增大,且硝酸钾的溶解度受温度变化影响较大,氯化钠的溶解度受温度变化影响较小,提纯含有少量氯化钠的硝酸钾溶液可采用降温结晶或冷却热的饱和溶液的方法。
(1)20.9
(2)${NH4Cl}>{NaCl}={KNO3}$
(3)${NaCl}>{NH4Cl}>{KNO3}$
(4)${NH4Cl}>{NaCl}={KNO3}$
(5)降温结晶(或冷却热的饱和溶液) 【解析】
(1)分析溶解度曲线图,$10\ {^{\circ}C}$时硝酸钾的溶解度为20.9 g。
(2)分析溶解度曲线图,$t\ {^{\circ}C}$时三种物质溶解度大小关系为氯化铵>氯化钠=硝酸钾。
(3)$40\ {^{\circ}C}$时三种物质溶解度大小关系为硝酸钾>氯化铵>氯化钠,此时配制三种物质的饱和溶液100 g,所需水的质量大小关系为氯化钠>氯化铵>硝酸钾。
(4)三种物质的溶解度均随温度升高而增大,将$40\ {^{\circ}C}$时三种物质的饱和溶液同时降温至$t\ {^{\circ}C}$,均有晶体析出,分别得到$t\ {^{\circ}C}$时三种物质的饱和溶液,根据饱和溶液溶质质量分数公式以及$t\ {^{\circ}C}$时三种物质溶解度大小关系(氯化铵>氯化钠=硝酸钾),可知降温后所得溶液溶质质量分数大小关系为氯化铵>氯化钠=硝酸钾。
(5)氯化钠、硝酸钾的溶解度均随温度升高而增大,且硝酸钾的溶解度受温度变化影响较大,氯化钠的溶解度受温度变化影响较小,提纯含有少量氯化钠的硝酸钾溶液可采用降温结晶或冷却热的饱和溶液的方法。
查看更多完整答案,请扫码查看


