第93页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
10. (教材习题改编)小明设计了下列四组物质,要求在一定条件下都能一步转化,其中
A.$\mathrm{F}\mathrm{e}\to \mathrm{F}\mathrm{e}\mathrm{S}{\mathrm{O}}_{4}$
B.$\mathrm{M}\mathrm{g}\to \mathrm{M}\mathrm{g}\mathrm{O}$
C.$\mathrm{A}\mathrm{l}\to \mathrm{A}\mathrm{l}\mathrm{C}{\mathrm{l}}_{3}$
D.$\mathrm{C}\mathrm{u}\to \mathrm{C}\mathrm{u}\mathrm{C}{\mathrm{l}}_{2}$
错
误
的是 (D
)A.$\mathrm{F}\mathrm{e}\to \mathrm{F}\mathrm{e}\mathrm{S}{\mathrm{O}}_{4}$
B.$\mathrm{M}\mathrm{g}\to \mathrm{M}\mathrm{g}\mathrm{O}$
C.$\mathrm{A}\mathrm{l}\to \mathrm{A}\mathrm{l}\mathrm{C}{\mathrm{l}}_{3}$
D.$\mathrm{C}\mathrm{u}\to \mathrm{C}\mathrm{u}\mathrm{C}{\mathrm{l}}_{2}$
答案:
D
11. 传统文化情境 经典篇目 现存最早论述炼丹的著作《周易参同契》中记载:"金入于猛火,色不夺精光。"说明黄金 (
A.容易燃烧
B.延展性好
C.有金属光泽
D.化学性质稳定
D
)A.容易燃烧
B.延展性好
C.有金属光泽
D.化学性质稳定
答案:
D
12. 向一定质量的稀盐酸中加入过量的铝粉,反应过程中某一量的变化与时间的关系如图所示。则纵坐标能表示的量是 (
A.生成氢气的质量
B.稀盐酸中$\mathrm{H}\mathrm{C}\mathrm{l}$的质量
C.金属铝的质量
D.溶液总质量
]
A
)A.生成氢气的质量
B.稀盐酸中$\mathrm{H}\mathrm{C}\mathrm{l}$的质量
C.金属铝的质量
D.溶液总质量
]
答案:
A
13. (逆袭卷)某合金6g与足量的稀硫酸充分反应后,生成0.2g氢气。该合金
A.锌和铁
B.锌和铝
C.铁和铜
D.铝和铁
不
可
能
是 (D
)A.锌和铁
B.锌和铝
C.铁和铜
D.铝和铁
答案:
D
14. (教材实验改编)兴趣小组同学为探究金属某些化学性质,进行下列学习活动。
活动一:探究金属与氧气反应
(1)将一镁条取出,发现其表面有一层白色物质,猜想这一物质有可能
(2)用砂纸将镁条打磨后在酒精灯上加热,可观察到的现象是
 甲
甲
乙
(3)甲实验中有明显现象的试管是
(4)同学们设计乙实验来比较镁、铁与稀盐酸反应快慢,观察到镁粉表面迅速产生气泡反应的化学方程式为
活动一:探究金属与氧气反应
(1)将一镁条取出,发现其表面有一层白色物质,猜想这一物质有可能
MgO
(写化学式)。(2)用砂纸将镁条打磨后在酒精灯上加热,可观察到的现象是
镁条剧烈燃烧,发出耀眼的白光,放出热量,生成白色固体
兴趣小组同学为探究金属某些化学性质,进行下列学习活动活动一:探究金属与氧气反应活动二:探究金属与酸的反应为探究金属与稀酸反应同们设计如图两组实验。 甲
甲乙
(3)甲实验中有明显现象的试管是
②
,反应的化学方程式为Fe+H₂SO₄$\xlongequal{\;\;}$FeSO₄+H₂↑
兴趣小组同学为探究金属某些化学性质活动一:探究金属与氧气反应活动二:探究金属与酸的反应为探究金属与稀酸反应同们设计如图两组实验。(4)同学们设计乙实验来比较镁、铁与稀盐酸反应快慢,观察到镁粉表面迅速产生气泡反应的化学方程式为
Mg+2HCl$\xlongequal{\;\;}$MgCl₂+H₂↑
,有同学认为该实验设计不够严谨,理由是金属镁和金属铁的形状不同
。
答案:
(1)MgO
(2)镁条剧烈燃烧,发出耀眼的白光,放出热量,生成白色固体
(3)② Fe+H₂SO₄$\xlongequal{\;\;}$FeSO₄+H₂↑
(4)Mg+2HCl$\xlongequal{\;\;}$MgCl₂+H₂↑ 金属镁和金属铁的形状不同
【解析】
(1)镁和氧气在常温下反应生成氧化镁,这层白色物质可能是氧化镁。
(2)镁条剧烈燃烧,发出耀眼的白光,放出热量,生成白色固体。
(3)铜不与稀硫酸反应,铁与稀硫酸反应时产生气泡,溶液由无色逐渐变为浅绿色,因此甲实验中有明显现象的是试管②,铁与稀硫酸反应生成硫酸亚铁和氢气,据此写出反应的化学方程式。
(4)镁与稀盐酸反应生成氯化镁和氢气,据此写出反应的化学方程式。实验中所用金属镁和金属铁的形状不同,不可根据实验现象来比较镁、铁与稀盐酸反应的快慢。
(1)MgO
(2)镁条剧烈燃烧,发出耀眼的白光,放出热量,生成白色固体
(3)② Fe+H₂SO₄$\xlongequal{\;\;}$FeSO₄+H₂↑
(4)Mg+2HCl$\xlongequal{\;\;}$MgCl₂+H₂↑ 金属镁和金属铁的形状不同
【解析】
(1)镁和氧气在常温下反应生成氧化镁,这层白色物质可能是氧化镁。
(2)镁条剧烈燃烧,发出耀眼的白光,放出热量,生成白色固体。
(3)铜不与稀硫酸反应,铁与稀硫酸反应时产生气泡,溶液由无色逐渐变为浅绿色,因此甲实验中有明显现象的是试管②,铁与稀硫酸反应生成硫酸亚铁和氢气,据此写出反应的化学方程式。
(4)镁与稀盐酸反应生成氯化镁和氢气,据此写出反应的化学方程式。实验中所用金属镁和金属铁的形状不同,不可根据实验现象来比较镁、铁与稀盐酸反应的快慢。
15.(教材实验改编)兴趣小组同学为探究金属某些化学性质,进行下列学习活动活动一:探究金属与氧气反应活动二:探究金属与酸的反应为探究金属与稀酸反应同们设计如图两组实验。甲实验中有明显现象反应的化学方程式为同学们设计乙实验来比较镁、铁与稀盐酸反应快慢,观察到镁粉表面迅速产生气泡反应的化学方程式为 ,实验室废弃物中有一包8g锌粉和铜粉的混合物,化学兴趣小组的同学们进行如下实验回收其中的铜粉。
 铜粉锌粉混合物8g逐渐加入稀硫酸至不再产生气泡用去稀硫酸100g过滤、洗涤干燥铜粉烧杯内物质总质量107.8g
铜粉锌粉混合物8g逐渐加入稀硫酸至不再产生气泡用去稀硫酸100g过滤、洗涤干燥铜粉烧杯内物质总质量107.8g
(1)反应中生成氢气的质量是
(2)计算回收铜粉的质量(忽略回收过程中铜粉的损失)。
(2)解:设混合物中锌粉的质量为x
Zn+H₂SO₄$\xlongequal{\;\;}$ZnSO₄+H₂↑
65 2
x 0.2 g
$\frac{65}{2}=\frac{x}{0.2\;\text{g}}$
x=6.5 g
回收铜粉的质量为8 g-6.5 g=1.5 g
答:回收铜粉的质量为1.5 g。
 铜粉锌粉混合物8g逐渐加入稀硫酸至不再产生气泡用去稀硫酸100g过滤、洗涤干燥铜粉烧杯内物质总质量107.8g
铜粉锌粉混合物8g逐渐加入稀硫酸至不再产生气泡用去稀硫酸100g过滤、洗涤干燥铜粉烧杯内物质总质量107.8g(1)反应中生成氢气的质量是
0.2
g实验室废弃物中有一包8g锌粉和铜粉的混合物,化学兴趣小组同学进行如下实验回收其中的铜粉。反应中生成氢气的质量是0.2
g。(2)计算回收铜粉的质量(忽略回收过程中铜粉的损失)。
(2)解:设混合物中锌粉的质量为x
Zn+H₂SO₄$\xlongequal{\;\;}$ZnSO₄+H₂↑
65 2
x 0.2 g
$\frac{65}{2}=\frac{x}{0.2\;\text{g}}$
x=6.5 g
回收铜粉的质量为8 g-6.5 g=1.5 g
答:回收铜粉的质量为1.5 g。
答案:
(1)0.2
(2)解:设混合物中锌粉的质量为x
Zn+H₂SO₄$\xlongequal{\;\;}$ZnSO₄+H₂↑
65 2
x 0.2 g
$\frac{65}{2}=\frac{x}{0.2\;\text{g}}$
x=6.5 g
回收铜粉的质量为8 g-6.5 g=1.5 g
答:回收铜粉的质量为1.5 g。
(1)0.2
(2)解:设混合物中锌粉的质量为x
Zn+H₂SO₄$\xlongequal{\;\;}$ZnSO₄+H₂↑
65 2
x 0.2 g
$\frac{65}{2}=\frac{x}{0.2\;\text{g}}$
x=6.5 g
回收铜粉的质量为8 g-6.5 g=1.5 g
答:回收铜粉的质量为1.5 g。
16. (中考新考法·数字化实验)小组同学利用图1装置进行实验,将2份等质量且过量的锌粉分别与等体积、浓度分别为5%和15%的稀盐酸反应。测得两次实验中压强随时间的变化关系如图2所示。
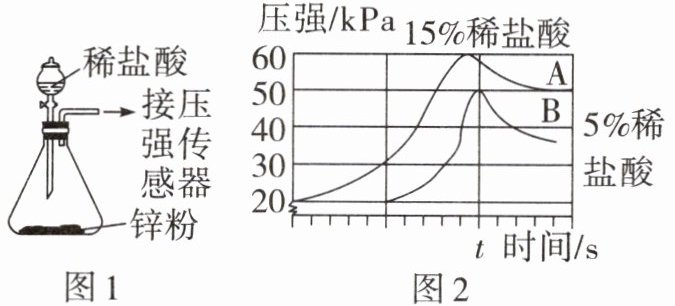
(1)打开分液漏斗的活塞,可观察到的现象是
(2)图2中A曲线始终高于B曲线,由此可得出的结论是
(3)ts后A、B曲线都下降的原因是
(4)反应结束后,锥形瓶内溶液中除水外还一定含有的物质是

(1)打开分液漏斗的活塞,可观察到的现象是
固体逐渐溶解,有气泡产生
。(2)图2中A曲线始终高于B曲线,由此可得出的结论是
稀盐酸浓度越大,与锌反应的速率越快(或与等量锌反应时,15%的盐酸比5%的盐酸产生的氢气更多等,合理即可)
。(3)ts后A、B曲线都下降的原因是
t s时,稀盐酸被消耗完,反应结束,温度逐渐恢复至室温,装置内压强减小
。(4)反应结束后,锥形瓶内溶液中除水外还一定含有的物质是
ZnCl₂
。
答案:
(1)固体逐渐溶解,有气泡产生
(2)稀盐酸浓度越大,与锌反应的速率越快(或与等量锌反应时,15%的盐酸比5%的盐酸产生的氢气更多等,合理即可)
(3)t s时,稀盐酸被消耗完,反应结束,温度逐渐恢复至室温,装置内压强减小
(4)ZnCl₂
【解析】
(1)锌能与稀盐酸反应产生氢气,因此打开分液漏斗的活塞,可观察到固体逐渐溶解,有气泡产生。
(2)分析图2中A曲线始终高于B曲线,说明稀盐酸的浓度越大,与锌反应的速率越快或与等量锌反应时,15%的盐酸产生的氢气比5%的盐酸产生的氢气更多等。
(3)锌与稀盐酸反应产生气体且反应放热,使装置内压强增大,t s时,稀盐酸被消耗完,反应结束,温度逐渐恢复至室温,装置内压强减小。
(4)锌和稀盐酸反应生成氯化锌和氢气,因此反应结束后锥形瓶内溶液中除水外还一定含有氯化锌。
(1)固体逐渐溶解,有气泡产生
(2)稀盐酸浓度越大,与锌反应的速率越快(或与等量锌反应时,15%的盐酸比5%的盐酸产生的氢气更多等,合理即可)
(3)t s时,稀盐酸被消耗完,反应结束,温度逐渐恢复至室温,装置内压强减小
(4)ZnCl₂
【解析】
(1)锌能与稀盐酸反应产生氢气,因此打开分液漏斗的活塞,可观察到固体逐渐溶解,有气泡产生。
(2)分析图2中A曲线始终高于B曲线,说明稀盐酸的浓度越大,与锌反应的速率越快或与等量锌反应时,15%的盐酸产生的氢气比5%的盐酸产生的氢气更多等。
(3)锌与稀盐酸反应产生气体且反应放热,使装置内压强增大,t s时,稀盐酸被消耗完,反应结束,温度逐渐恢复至室温,装置内压强减小。
(4)锌和稀盐酸反应生成氯化锌和氢气,因此反应结束后锥形瓶内溶液中除水外还一定含有氯化锌。
查看更多完整答案,请扫码查看


