第114页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
直接根据纯净物质量计算溶质质量分数^7^6考
1. 生产情境 工业生产 工业废气${SO_2}$(化学性质与${CO_2}$相似)常用氢氧化钠溶液进行吸收处理。某工厂用10 t氢氧化钠溶液恰好吸收工厂废气中的0.64 t${SO_2}$,试计算所用氢氧化钠溶液的溶质质量分数。
1. 生产情境 工业生产 工业废气${SO_2}$(化学性质与${CO_2}$相似)常用氢氧化钠溶液进行吸收处理。某工厂用10 t氢氧化钠溶液恰好吸收工厂废气中的0.64 t${SO_2}$,试计算所用氢氧化钠溶液的溶质质量分数。
答案:
1.解:设10 t氢氧化钠溶液中溶质的质量为x
SO₂+2NaOH=Na₂SO₃+H₂O
64 80
0.64 t x
$\frac {80}{64}=\frac {x}{0.64\ t}$
x=0.8 t
所用氢氧化钠溶液的溶质质量分数为$\frac {0.8\ t}{10\ t}×$100%=8%
答:所用氢氧化钠溶液的溶质质量分数为8%。
SO₂+2NaOH=Na₂SO₃+H₂O
64 80
0.64 t x
$\frac {80}{64}=\frac {x}{0.64\ t}$
x=0.8 t
所用氢氧化钠溶液的溶质质量分数为$\frac {0.8\ t}{10\ t}×$100%=8%
答:所用氢氧化钠溶液的溶质质量分数为8%。
根据质量差计算溶质质量分数^2^8考
2. (教材习题改编)为确定实验室某瓶盐酸(如图1)中溶质的质量分数是否与标签标示相符,小明同学利用此盐酸与足量铁粉反应(杂质不参与反应,忽略${HCl}$的挥发性)进行实验探究,实验过程及数据如图2所示。通过计算,确定该盐酸中溶质的质量分数是否与标签标示相符。
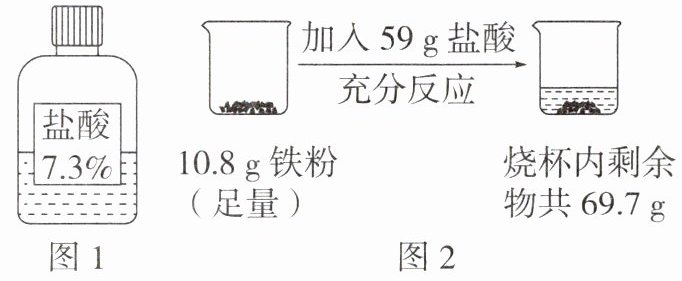
2. (教材习题改编)为确定实验室某瓶盐酸(如图1)中溶质的质量分数是否与标签标示相符,小明同学利用此盐酸与足量铁粉反应(杂质不参与反应,忽略${HCl}$的挥发性)进行实验探究,实验过程及数据如图2所示。通过计算,确定该盐酸中溶质的质量分数是否与标签标示相符。

答案:
2.解:产生氢气的质量为10.8 g+59 g-69.7 g=0.1 g
设59 g盐酸中溶质的质量为x
Fe+2HCl=FeCl₂+H₂↑
73 2
x 0.1 g
$\frac {73}{2}=\frac {x}{0.1\ g}$
x=3.65 g
该盐酸中溶质的质量分数为$\frac {3.65\ g}{59\ g}×100\% \approx 6.2\% ,$
6.2%<7.3%
答:该盐酸中溶质的质量分数与标签标示不相符。
设59 g盐酸中溶质的质量为x
Fe+2HCl=FeCl₂+H₂↑
73 2
x 0.1 g
$\frac {73}{2}=\frac {x}{0.1\ g}$
x=3.65 g
该盐酸中溶质的质量分数为$\frac {3.65\ g}{59\ g}×100\% \approx 6.2\% ,$
6.2%<7.3%
答:该盐酸中溶质的质量分数与标签标示不相符。
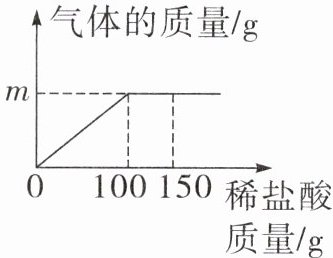
3. (定心卷改编)日常生活情境 鸡蛋壳 化学兴趣小组同学为测定鸡蛋壳中碳酸钙的含量,现取12.5 g碎鸡蛋壳放在烧杯中,向其中滴加7.3%的稀盐酸,使之充分反应(杂质不溶于水,且不与稀盐酸反应),反应过程中生成气体的质量与加入稀盐酸质量的关系如图所示。
(1)m的值为______
(2)计算该鸡蛋壳中碳酸钙的质量分数。
解:设12.5 g碎鸡蛋壳中碳酸钙的质量为x
CaCO₃+2HCl=CaCl₂+H₂O+CO₂↑
100 44
x 4.4 g
$\frac {100}{44}=\frac {x}{4.4\ g}$
x=10 g
该鸡蛋壳中碳酸钙的质量分数为$\frac {10\ g}{12.5\ g}×100\% =80\% $
答:该鸡蛋壳中碳酸钙的质量分数为80%。
(1)m的值为______
4.4
。(2)计算该鸡蛋壳中碳酸钙的质量分数。

解:设12.5 g碎鸡蛋壳中碳酸钙的质量为x
CaCO₃+2HCl=CaCl₂+H₂O+CO₂↑
100 44
x 4.4 g
$\frac {100}{44}=\frac {x}{4.4\ g}$
x=10 g
该鸡蛋壳中碳酸钙的质量分数为$\frac {10\ g}{12.5\ g}×100\% =80\% $
答:该鸡蛋壳中碳酸钙的质量分数为80%。
答案:
3.
(1)4.4
(2)解:解法一:设12.5 g碎鸡蛋壳中碳酸钙的质量为x
CaCO₃+2HCl=CaCl₂+H₂O+CO₂↑₃
100 73
x 100 g×7.3%$\frac {100}{73}=\frac {x}{100\ g×7.3\% }$x=1₀ g
解法二:设12.5 g碎鸡蛋壳中碳酸钙的质量为x
CaCO₃+2HCl=CaCl₂+H₂O+CO₂↑
100 44x 4.4 g$\frac {100}{44}=\frac {x}{4.4\ g}$x=10 g
该鸡蛋壳中碳酸钙的质量分数为$\frac {₁₀\ g}{12.5\ g}×$100%=80%答:该鸡蛋壳中碳酸钙₃的质量分数为80%。【解析】
(1)由图可得,当加入100 g稀盐酸时,生成气体的质量为m g。当继续加入稀盐酸时,气体的质量不再增加,说明鸡蛋壳中的碳酸钙已完全反应₃。将m g代入化学方程式中计算如下:CaCO₃+2HCl=CaCl₂+H₂O+CO₂↑73 441₀₀ g×7.3% m g$\frac {44}{73}=\frac {m\ g}{100\ g×7.3\% }$m=4₄
(1)4.4
(2)解:解法一:设12.5 g碎鸡蛋壳中碳酸钙的质量为x
CaCO₃+2HCl=CaCl₂+H₂O+CO₂↑₃
100 73
x 100 g×7.3%$\frac {100}{73}=\frac {x}{100\ g×7.3\% }$x=1₀ g
解法二:设12.5 g碎鸡蛋壳中碳酸钙的质量为x
CaCO₃+2HCl=CaCl₂+H₂O+CO₂↑
100 44x 4.4 g$\frac {100}{44}=\frac {x}{4.4\ g}$x=10 g
该鸡蛋壳中碳酸钙的质量分数为$\frac {₁₀\ g}{12.5\ g}×$100%=80%答:该鸡蛋壳中碳酸钙₃的质量分数为80%。【解析】
(1)由图可得,当加入100 g稀盐酸时,生成气体的质量为m g。当继续加入稀盐酸时,气体的质量不再增加,说明鸡蛋壳中的碳酸钙已完全反应₃。将m g代入化学方程式中计算如下:CaCO₃+2HCl=CaCl₂+H₂O+CO₂↑73 441₀₀ g×7.3% m g$\frac {44}{73}=\frac {m\ g}{100\ g×7.3\% }$m=4₄
4. 日常生活情境 医疗用品 过氧化氢溶液俗称双氧水,具有清除厌氧菌等作用,可以用于清洁伤口等。小明同学从家庭小药箱中取120.0 g某医用双氧水倒入烧杯中,然后加入3 g二氧化锰,每隔30 s观察并记录烧杯及物质的总质量如表所示,直到实验结束。请回答下列问题:
|时间/s|0|30|60|90|120|150|
|总质量/g|203.0|202.3|201.9|201.6|201.4|201.4|
(1)此实验说明影响化学反应速率的因素之一是
(2)请计算该双氧水中过氧化氢的质量分数(保留一位小数)。
解:根据质量守恒定律,生成氧气的质量为203.0g - 201.4g = 1.6g。
设该双氧水中过氧化氢的质量为x。
2H₂O₂$\stackrel{MnO_2}{=}$2H₂O + O₂↑
68 32
x 1.6g
$\frac{68}{32}$=$\frac{x}{1.6g}$
x=3.4g
该双氧水中过氧化氢的质量分数为$\frac{3.4g}{120.0g}$×100%≈2.8%
答:该双氧水中过氧化氢的质量分数为2.8%。
|时间/s|0|30|60|90|120|150|
|总质量/g|203.0|202.3|201.9|201.6|201.4|201.4|
(1)此实验说明影响化学反应速率的因素之一是
催化剂
。(2)请计算该双氧水中过氧化氢的质量分数(保留一位小数)。
解:根据质量守恒定律,生成氧气的质量为203.0g - 201.4g = 1.6g。
设该双氧水中过氧化氢的质量为x。
2H₂O₂$\stackrel{MnO_2}{=}$2H₂O + O₂↑
68 32
x 1.6g
$\frac{68}{32}$=$\frac{x}{1.6g}$
x=3.4g
该双氧水中过氧化氢的质量分数为$\frac{3.4g}{120.0g}$×100%≈2.8%
答:该双氧水中过氧化氢的质量分数为2.8%。
答案:
(1)催化剂
(2)解:根据质量守恒定律,生成氧气的质量为203.0g - 201.4g = 1.6g。
设该双氧水中过氧化氢的质量为x。
2H₂O₂$\stackrel{MnO_2}{=}$2H₂O + O₂↑
68 32
x 1.6g
$\frac{68}{32}$=$\frac{x}{1.6g}$
x=3.4g
该双氧水中过氧化氢的质量分数为$\frac{3.4g}{120.0g}$×100%≈2.8%
答:该双氧水中过氧化氢的质量分数为2.8%。
(1)催化剂
(2)解:根据质量守恒定律,生成氧气的质量为203.0g - 201.4g = 1.6g。
设该双氧水中过氧化氢的质量为x。
2H₂O₂$\stackrel{MnO_2}{=}$2H₂O + O₂↑
68 32
x 1.6g
$\frac{68}{32}$=$\frac{x}{1.6g}$
x=3.4g
该双氧水中过氧化氢的质量分数为$\frac{3.4g}{120.0g}$×100%≈2.8%
答:该双氧水中过氧化氢的质量分数为2.8%。
查看更多完整答案,请扫码查看


