第27页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
11. (中考新考法·模型构建)如图是小明同学学习物质结构后以氧气为例进行的梳理,下列叙述中

A.a为氧分子
B.b为氧原子
C.c为氧的原子核
D.b的质量主要集中在d上
不
正
确
的是 (C
) 
A.a为氧分子
B.b为氧原子
C.c为氧的原子核
D.b的质量主要集中在d上
答案:
解:分析图示可知,氧气由a构成,a由b构成,b由c和d构成,d包含质子和中子。
A.氧气由氧分子构成,a为氧分子,正确。
B.氧分子由氧原子构成,b为氧原子,正确。
C.原子由原子核和核外电子构成,d包含质子和中子应为原子核,c应为核外电子,故C错误。
D.原子质量主要集中在原子核(d)上,正确。
结论:不正确的是C。
答案:C
A.氧气由氧分子构成,a为氧分子,正确。
B.氧分子由氧原子构成,b为氧原子,正确。
C.原子由原子核和核外电子构成,d包含质子和中子应为原子核,c应为核外电子,故C错误。
D.原子质量主要集中在原子核(d)上,正确。
结论:不正确的是C。
答案:C
12. 科技前沿情境 新科技 科学家利用碳-14 金刚石电池技术,为太空探索提供了稳定能源。碳-14 含有6个质子和8个中子,碳-12 原子核外电子数为6,中子数也为6(已知:相对原子质量≈质子数+中子数),下列有关说法正确的是 (
A.碳-12 和碳-14 是同一种原子
B.碳-12 和碳-14 的中子数相同
C.碳-12 和碳-14 的区别是质子数不同
D.碳-14 的相对原子质量大于碳-12
D
)A.碳-12 和碳-14 是同一种原子
B.碳-12 和碳-14 的中子数相同
C.碳-12 和碳-14 的区别是质子数不同
D.碳-14 的相对原子质量大于碳-12
答案:
【解析】:
本题主要考查了原子的构成以及相对原子质量的概念。
A选项,碳-12和碳-14虽然质子数相同,但中子数不同,因此它们不是同一种原子,而是碳元素的两种不同核素,所以A选项错误。
B选项,根据题目信息,碳-12的中子数为6,而碳-14的中子数为8,显然不同,所以B选项错误。
C选项,碳-12和碳-14都是碳的同位素,它们的质子数都是6,区别在于中子数不同,所以C选项错误。
D选项,根据相对原子质量的定义,它约等于质子数与中子数之和。由于碳-14的中子数比碳-12多2,因此碳-14的相对原子质量必然大于碳-12,所以D选项正确。
【答案】:D
本题主要考查了原子的构成以及相对原子质量的概念。
A选项,碳-12和碳-14虽然质子数相同,但中子数不同,因此它们不是同一种原子,而是碳元素的两种不同核素,所以A选项错误。
B选项,根据题目信息,碳-12的中子数为6,而碳-14的中子数为8,显然不同,所以B选项错误。
C选项,碳-12和碳-14都是碳的同位素,它们的质子数都是6,区别在于中子数不同,所以C选项错误。
D选项,根据相对原子质量的定义,它约等于质子数与中子数之和。由于碳-14的中子数比碳-12多2,因此碳-14的相对原子质量必然大于碳-12,所以D选项正确。
【答案】:D
13. 化学元素与人体健康息息相关。
(1)碘-131(碘的相对原子质量为 131)是一种碘的放射性同位素,能用于治疗甲状腺疾病,碘原子中含有184个微观粒子,其中有78个不带电荷,则其质子数为
(2)氚是氢的一种放射性同位素,可用于医疗诊断,如图是氚原子的结构示意图,下列有关说法正确的是
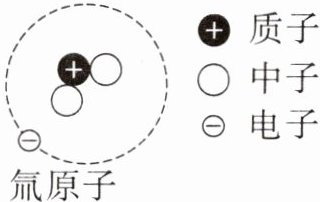
A. 一个氚原子只有1个电子
B. 氚原子的核电荷数是2
C. 氚原子中含有3个质子,没有中子
(3)在日常生活中,我们食用加碘食盐中的碘元素能够预防甲状腺肿大,某种袋装加碘食盐的标签如图所示。
请分析,一袋该盐中含碘的质量为
(1)碘-131(碘的相对原子质量为 131)是一种碘的放射性同位素,能用于治疗甲状腺疾病,碘原子中含有184个微观粒子,其中有78个不带电荷,则其质子数为
53
。(2)氚是氢的一种放射性同位素,可用于医疗诊断,如图是氚原子的结构示意图,下列有关说法正确的是
A
(填字母)。
A. 一个氚原子只有1个电子
B. 氚原子的核电荷数是2
C. 氚原子中含有3个质子,没有中子
(3)在日常生活中,我们食用加碘食盐中的碘元素能够预防甲状腺肿大,某种袋装加碘食盐的标签如图所示。
请分析,一袋该盐中含碘的质量为
15mg
。
答案:
【解析】:
(1)原子中质子数等于核外电子数,不显电性,已知碘原子中含有184个微观粒子,其中有78个不带电荷即中子数为78,则质子数与电子数之和为:$184 - 78 = 106$,又因为质子数等于电子数,所以质子数为$106÷2 = 53$。
(2)A选项:从氚原子的结构示意图可知,其核外有1个电子,所以一个氚原子只有1个电子,A正确;
B选项:氚原子核内有1个质子,质子带正电,核电荷数等于质子数,所以氚原子的核电荷数是1,B错误;
C选项:氚原子中含有1个质子,中子数为$3 - 1 = 2$,C错误。
故A选项正确。
(3)由标签可知该加碘食盐含碘量为$(20~30)mg/kg$,一袋盐质量为500g,按含碘量最大值$30mg/kg$计算,一袋盐中含碘的质量为:$0.5kg×30mg/kg = 15mg$。
【答案】:
(1)53
(2)A
(3)15mg
(1)原子中质子数等于核外电子数,不显电性,已知碘原子中含有184个微观粒子,其中有78个不带电荷即中子数为78,则质子数与电子数之和为:$184 - 78 = 106$,又因为质子数等于电子数,所以质子数为$106÷2 = 53$。
(2)A选项:从氚原子的结构示意图可知,其核外有1个电子,所以一个氚原子只有1个电子,A正确;
B选项:氚原子核内有1个质子,质子带正电,核电荷数等于质子数,所以氚原子的核电荷数是1,B错误;
C选项:氚原子中含有1个质子,中子数为$3 - 1 = 2$,C错误。
故A选项正确。
(3)由标签可知该加碘食盐含碘量为$(20~30)mg/kg$,一袋盐质量为500g,按含碘量最大值$30mg/kg$计算,一袋盐中含碘的质量为:$0.5kg×30mg/kg = 15mg$。
【答案】:
(1)53
(2)A
(3)15mg
14. (教材习题改编) 一题多变
14.1 已知实际质量,计算相对原子质量
已知碳-12 原子的质量约为$1.993×10^{-26}kg$,一种硫原子的质量约为$5.314×10^{-26}kg$。计算这种硫原子的相对原子质量(计算结果保留一位小数)。
14.2 已知相对原子质量,计算原子实际质量
已知碳-12 原子的质量约为$1.993×10^{-26}kg$,镁原子的相对原子质量约为24,计算镁原子 的实际质量。
14.1 已知实际质量,计算相对原子质量
已知碳-12 原子的质量约为$1.993×10^{-26}kg$,一种硫原子的质量约为$5.314×10^{-26}kg$。计算这种硫原子的相对原子质量(计算结果保留一位小数)。
14.2 已知相对原子质量,计算原子实际质量
已知碳-12 原子的质量约为$1.993×10^{-26}kg$,镁原子的相对原子质量约为24,计算镁原子 的实际质量。
答案:
【解析】:
14.1 本题考查相对原子质量的计算。相对原子质量是指以一个碳-12原子质量的1/12作为标准,其他原子的质量跟它相比较所得到的比。公式为:${\text{相对原子质量}} = \frac{{\text{原子的实际质量}}}{{\text{碳-12原子质量} × \frac{1}{12}}}$。将给定的数据代入公式进行计算。
14.2 本题考查原子实际质量的计算。根据相对原子质量的定义,我们可以通过相对原子质量反推出原子的实际质量。公式可以变形为:${\text{原子的实际质量}} = \text{相对原子质量} × \text{碳-12原子质量} × \frac{1}{12}$。将给定的数据代入公式进行计算。
【答案】:
14.1 解:硫原子的相对原子质量为
$\frac{{5.314 × 10^{- 26} \text{kg}}}{{1.993 × 10^{- 26} \text{kg} × \frac{1}{12}}} \approx 32.0$
答:这种硫原子的相对原子质量为32.0。
14.2 解:镁原子的实际质量为
$24 × 1.993 × 10^{- 26} \text{kg} × \frac{1}{12} = 3.986 × 10^{- 26} \text{kg}$
答:镁原子的实际质量为$3.986 × 10^{- 26} \text{kg}$。
14.1 本题考查相对原子质量的计算。相对原子质量是指以一个碳-12原子质量的1/12作为标准,其他原子的质量跟它相比较所得到的比。公式为:${\text{相对原子质量}} = \frac{{\text{原子的实际质量}}}{{\text{碳-12原子质量} × \frac{1}{12}}}$。将给定的数据代入公式进行计算。
14.2 本题考查原子实际质量的计算。根据相对原子质量的定义,我们可以通过相对原子质量反推出原子的实际质量。公式可以变形为:${\text{原子的实际质量}} = \text{相对原子质量} × \text{碳-12原子质量} × \frac{1}{12}$。将给定的数据代入公式进行计算。
【答案】:
14.1 解:硫原子的相对原子质量为
$\frac{{5.314 × 10^{- 26} \text{kg}}}{{1.993 × 10^{- 26} \text{kg} × \frac{1}{12}}} \approx 32.0$
答:这种硫原子的相对原子质量为32.0。
14.2 解:镁原子的实际质量为
$24 × 1.993 × 10^{- 26} \text{kg} × \frac{1}{12} = 3.986 × 10^{- 26} \text{kg}$
答:镁原子的实际质量为$3.986 × 10^{- 26} \text{kg}$。
15.(教材习题改编)A、B,C为三种不同的原子,他们的核电荷数依次增加 3_。请回答下列问题(已知:相对原子质量≈质子数+中子数)。
(1)根据以上事实,结合下列数据,填写下列表格。
|原子种类 |质子数 |中子数 |核外电子数|核电荷数|相对原子质量 |相对原子质量|
|A |
|B |11 |
|C |
(2)(中考新考法·结论开放)分析表中数据,你能从中获得哪些信(任写两条)?
①
②
(1)根据以上事实,结合下列数据,填写下列表格。
|原子种类 |质子数 |中子数 |核外电子数|核电荷数|相对原子质量 |相对原子质量|
|A |
8
|8 |8
|8
|16 | ||B |11 |
12
|11
|11
|23 | ||C |
14
|14
|14
|14 |28 | | (2)(中考新考法·结论开放)分析表中数据,你能从中获得哪些信(任写两条)?
①
在原子中,质子数等于核外电子数,也等于核电荷数
。②
相对原子质量约等于质子数与中子数之和
。
答案:
【解析】:
(1) 对于原子A:
已知相对原子质量约为16,且中子数为8,由相对原子质量≈质子数+中子数得,质子数 = 16 - 8 = 8。
由于原子中质子数等于核外电子数,也等于核电荷数,所以核外电子数和核电荷数均为8。
对于原子B:
已知质子数为11,相对原子质量为23,由相对原子质量≈质子数+中子数得,中子数 = 23 - 11 = 12。
同样,核外电子数和核电荷数均等于质子数,即11。
对于原子C:
已知核电荷数为14,由于核电荷数等于质子数,所以质子数也为14。
相对原子质量为28,由相对原子质量≈质子数+中子数得,中子数 = 28 - 14 = 14。
核外电子数等于质子数,即14。
(2) 分析表中数据,我们可以得出以下结论:
① 在原子中,质子数等于核外电子数,也等于核电荷数。
② 相对原子质量约等于质子数与中子数之和。
【答案】:
(1)
|原子种类 |质子数 |中子数 |核外电子数|核电荷数|相对原子质量 |
| --- | --- | --- | --- | --- | --- |
|A |8 |8 |8 |8 |16 |
|B |11 |12 |11 |11 |23 |
|C |14 |14 |14 |14 |28 |
(2) ① 在原子中,质子数等于核外电子数,也等于核电荷数。
② 相对原子质量约等于质子数与中子数之和。(答案合理即可)
(1) 对于原子A:
已知相对原子质量约为16,且中子数为8,由相对原子质量≈质子数+中子数得,质子数 = 16 - 8 = 8。
由于原子中质子数等于核外电子数,也等于核电荷数,所以核外电子数和核电荷数均为8。
对于原子B:
已知质子数为11,相对原子质量为23,由相对原子质量≈质子数+中子数得,中子数 = 23 - 11 = 12。
同样,核外电子数和核电荷数均等于质子数,即11。
对于原子C:
已知核电荷数为14,由于核电荷数等于质子数,所以质子数也为14。
相对原子质量为28,由相对原子质量≈质子数+中子数得,中子数 = 28 - 14 = 14。
核外电子数等于质子数,即14。
(2) 分析表中数据,我们可以得出以下结论:
① 在原子中,质子数等于核外电子数,也等于核电荷数。
② 相对原子质量约等于质子数与中子数之和。
【答案】:
(1)
|原子种类 |质子数 |中子数 |核外电子数|核电荷数|相对原子质量 |
| --- | --- | --- | --- | --- | --- |
|A |8 |8 |8 |8 |16 |
|B |11 |12 |11 |11 |23 |
|C |14 |14 |14 |14 |28 |
(2) ① 在原子中,质子数等于核外电子数,也等于核电荷数。
② 相对原子质量约等于质子数与中子数之和。(答案合理即可)
查看更多完整答案,请扫码查看


