第26页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
1. (教材习题改编)原子核中一定含有的微观粒子是 (
A.质子
B.中子
C.电子
D.中子和电子
A
)A.质子
B.中子
C.电子
D.中子和电子
答案:
【解析】:本题考查原子的构成。原子是由原子核和核外电子构成的,原子核一般是由质子和中子构成的,但有一种氢原子中不含中子,它的原子核内只有一个质子。因此,原子核中一定含有的微观粒子是质子。电子在原子核外绕核运动,不是原子核的组成部分。
【答案】:A
【答案】:A
2. 在原子的内部结构中,下列微观粒子中
A.原子核
B.质子
C.中子
D.电子
不
带
电荷的是 (C
)A.原子核
B.质子
C.中子
D.电子
答案:
【解析】:本题考查原子的内部结构和各组成粒子的电荷性质。原子是由原子核和核外电子构成的,原子核又由质子和中子构成。其中质子带正电荷,电子带负电荷,而中子是不带电荷的。根据这些知识点,我们可以对选项进行逐一分析:
A选项,原子核是由质子和中子构成的,质子带正电荷,所以原子核是带正电荷的,故A选项错误。
B选项,质子是原子核的组成部分,且质子带正电荷,故B选项错误。
C选项,中子是不带电荷的,它是原子核的组成部分之一,故C选项正确。
D选项,电子是围绕原子核运动的粒子,且电子带负电荷,故D选项错误。
【答案】:C
A选项,原子核是由质子和中子构成的,质子带正电荷,所以原子核是带正电荷的,故A选项错误。
B选项,质子是原子核的组成部分,且质子带正电荷,故B选项错误。
C选项,中子是不带电荷的,它是原子核的组成部分之一,故C选项正确。
D选项,电子是围绕原子核运动的粒子,且电子带负电荷,故D选项错误。
【答案】:C
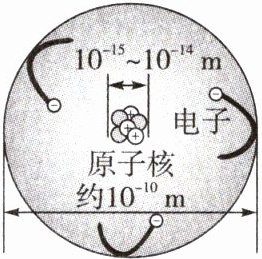
3. (教材图片改编)如图是经历了几代科学家的研究后,人们对原子结构的认识,下列有关说法
A.原子体积很小
B.电子在原子核外空间绕核运动
C.原子是由原子核和核外电子构成的
D.整个原子带负电荷
不
正
确
的是 (D
)
A.原子体积很小
B.电子在原子核外空间绕核运动
C.原子是由原子核和核外电子构成的
D.整个原子带负电荷
答案:
【解析】:
A选项:原子是真实存在的,原子体积很小,故A选项正确;
B选项:电子在原子核外空间绕核做高速运动,故B选项正确;
C选项:原子是由原子核和核外电子构成的,故C选项正确;
D选项:原子核所带的正电荷数与核外电子所带的负电荷数相等,电性相反,所以整个原子不显电性,故D选项错误。
【答案】:D
A选项:原子是真实存在的,原子体积很小,故A选项正确;
B选项:电子在原子核外空间绕核做高速运动,故B选项正确;
C选项:原子是由原子核和核外电子构成的,故C选项正确;
D选项:原子核所带的正电荷数与核外电子所带的负电荷数相等,电性相反,所以整个原子不显电性,故D选项错误。
【答案】:D
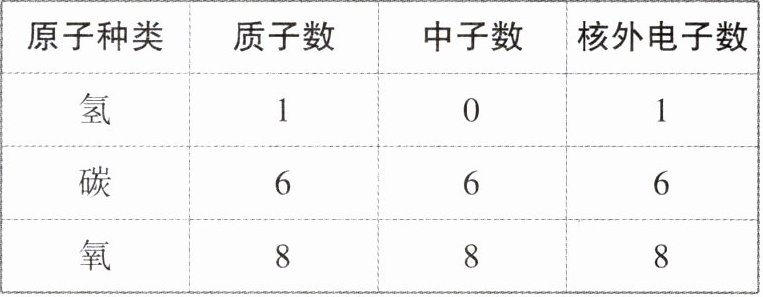
4. (教材素材改编)几种原子的构成如表所示,下列说法正确的是 (
|原子种类|质子数|中子数|核外电子数|
|氢|1|0|1|
|碳|6|6|6|
|氧|8|8|8|
A.质子数不同,原子种类不同
B.质子数一定等于中子数
C.中子数一定等于核外电子数
D.原子都由质子、中子和电子构成
A
)|原子种类|质子数|中子数|核外电子数|
|氢|1|0|1|
|碳|6|6|6|
|氧|8|8|8|

A.质子数不同,原子种类不同
B.质子数一定等于中子数
C.中子数一定等于核外电子数
D.原子都由质子、中子和电子构成
答案:
【解析】:
A选项:从表格中可以看到,氢、碳、氧的质子数分别为1、6、8,对应的原子种类也不同,所以质子数不同,原子种类不同,该选项正确。
B选项:氢原子质子数为1,中子数为0;碳原子质子数为6,中子数为6;氧原子质子数为8,中子数为8,并不是所有原子的质子数都等于中子数,该选项错误。
C选项:氢原子中子数为0,核外电子数为1;碳原子中子数为6,核外电子数为6;氧原子中子数为8,核外电子数为8,并不是所有原子的中子数都等于核外电子数,该选项错误。
D选项:氢原子中没有中子,所以并不是所有原子都由质子、中子和电子构成,该选项错误。
【答案】:A
A选项:从表格中可以看到,氢、碳、氧的质子数分别为1、6、8,对应的原子种类也不同,所以质子数不同,原子种类不同,该选项正确。
B选项:氢原子质子数为1,中子数为0;碳原子质子数为6,中子数为6;氧原子质子数为8,中子数为8,并不是所有原子的质子数都等于中子数,该选项错误。
C选项:氢原子中子数为0,核外电子数为1;碳原子中子数为6,核外电子数为6;氧原子中子数为8,核外电子数为8,并不是所有原子的中子数都等于核外电子数,该选项错误。
D选项:氢原子中没有中子,所以并不是所有原子都由质子、中子和电子构成,该选项错误。
【答案】:A
5. (黑白卷)一种碳原子可用于检测人体胃肠道运动,其原子核内有6个质子和7个中子,则该碳原子的核外电子数为 (
A.1
B.6
C.7
D.13
B
)A.1
B.6
C.7
D.13
答案:
解:在原子中,核外电子数=质子数。已知该碳原子原子核内有6个质子,因此其核外电子数为6。
答案:B
答案:B
6. 月球上有丰富的核能原料 He-3。已知 He-3 原子核内有2个质子和1个中子,若"●"表示质子、"○"表示中子、"·"表示电子,下列原子模型能表示 He-3 的是 (
C
)
答案:
C
7. 用下列符合条件的微观粒子的序号填空。
①原子 ②原子核 ③质子 ④中子 ⑤电子
(1)带正电荷的微观粒子是
(2)带负电荷的微观粒子是
(3)不显电性或不带电荷的微观粒子是
(4)在同一原子中数量关系一定相等的微观粒子是
①原子 ②原子核 ③质子 ④中子 ⑤电子
(1)带正电荷的微观粒子是
②③
。(2)带负电荷的微观粒子是
⑤
。(3)不显电性或不带电荷的微观粒子是
①④
。(4)在同一原子中数量关系一定相等的微观粒子是
③⑤
。
答案:
【解析】:
本题主要考查了原子的构成及其微粒间的数量关系。
(1)在原子中,原子核带正电,包括质子和中子,其中质子带正电,中子不带电。因此,带正电荷的微观粒子是原子核和质子。
(2)在原子中,电子围绕原子核运动,并且带负电。因此,带负电荷的微观粒子是电子。
(3)原子是由原子核和核外电子构成的,原子核带的正电荷数(即核电荷数)等于核内质子数,但原子整体不显电性。同时,中子也不带电。因此,不显电性或不带电荷的微观粒子是原子和中子。
(4)在原子中,质子数等于电子数,以保持原子的电中性。因此,在同一原子中数量关系一定相等的微观粒子是质子和电子。
【答案】:
(1)②③
(2)⑤
(3)①④
(4)③⑤
本题主要考查了原子的构成及其微粒间的数量关系。
(1)在原子中,原子核带正电,包括质子和中子,其中质子带正电,中子不带电。因此,带正电荷的微观粒子是原子核和质子。
(2)在原子中,电子围绕原子核运动,并且带负电。因此,带负电荷的微观粒子是电子。
(3)原子是由原子核和核外电子构成的,原子核带的正电荷数(即核电荷数)等于核内质子数,但原子整体不显电性。同时,中子也不带电。因此,不显电性或不带电荷的微观粒子是原子和中子。
(4)在原子中,质子数等于电子数,以保持原子的电中性。因此,在同一原子中数量关系一定相等的微观粒子是质子和电子。
【答案】:
(1)②③
(2)⑤
(3)①④
(4)③⑤
8. (教材资料卡片改编)对相对原子质量的测定作出卓越贡献的中国科学家是 (
A.屠呦呦
B.张青莲
C.袁隆平
D.侯德榜
B
)A.屠呦呦
B.张青莲
C.袁隆平
D.侯德榜
答案:
【解析】:本题考查的是化学史知识,特别是关于相对原子质量测定方面的贡献。我们需要对每个选项中的科学家及其主要贡献进行分析。
A选项,屠呦呦的主要贡献是发现青蒿素,与相对原子质量的测定无关,故A错误。
B选项,张青莲教授为相对原子质量的测定做出了卓越贡献,他精确测定了多种元素的相对原子质量,故B正确。
C选项,袁隆平的主要贡献是杂交水稻的研究,与相对原子质量的测定无关,故C错误。
D选项,侯德榜的主要贡献是发明了侯氏制碱法,与相对原子质量的测定也无关,故D错误。
【答案】:B
A选项,屠呦呦的主要贡献是发现青蒿素,与相对原子质量的测定无关,故A错误。
B选项,张青莲教授为相对原子质量的测定做出了卓越贡献,他精确测定了多种元素的相对原子质量,故B正确。
C选项,袁隆平的主要贡献是杂交水稻的研究,与相对原子质量的测定无关,故C错误。
D选项,侯德榜的主要贡献是发明了侯氏制碱法,与相对原子质量的测定也无关,故D错误。
【答案】:B
9. 关于相对原子质量的说法
A.碳原子的相对原子质量约为 12
B.相对原子质量表示各类原子实际质量的相对大小
C.氢原子的相对原子质量约为1,所以氢原子的质量约为1g
D.相对原子质量是一个原子实际质量与一个碳-12 原子实际质量的$\frac {1}{12}$的比值
不
正
确
的是 (C
)A.碳原子的相对原子质量约为 12
B.相对原子质量表示各类原子实际质量的相对大小
C.氢原子的相对原子质量约为1,所以氢原子的质量约为1g
D.相对原子质量是一个原子实际质量与一个碳-12 原子实际质量的$\frac {1}{12}$的比值
答案:
【解析】:
本题主要考察对相对原子质量概念的理解。
A选项,根据相对原子质量的定义,碳原子的相对原子质量确实约为12,这是以一个碳-12原子质量的$\frac {1}{12}$为标准进行比较而得出的结果,所以A选项是正确的。
B选项,相对原子质量是用来表示各类原子实际质量的相对大小的,它是一个比值,用于比较不同原子的质量大小,所以B选项也是正确的。
C选项,虽然氢原子的相对原子质量约为1,但这并不意味着氢原子的质量就约为1g。相对原子质量是一个比值,它表示的是原子质量与一个碳-12原子质量的$\frac {1}{12}$的比值,而不是原子的实际质量。因此,C选项是错误的。
D选项,相对原子质量确实是一个原子实际质量与一个碳-12原子实际质量的$\frac {1}{12}$的比值,这是相对原子质量的定义,所以D选项是正确的。
【答案】:C
本题主要考察对相对原子质量概念的理解。
A选项,根据相对原子质量的定义,碳原子的相对原子质量确实约为12,这是以一个碳-12原子质量的$\frac {1}{12}$为标准进行比较而得出的结果,所以A选项是正确的。
B选项,相对原子质量是用来表示各类原子实际质量的相对大小的,它是一个比值,用于比较不同原子的质量大小,所以B选项也是正确的。
C选项,虽然氢原子的相对原子质量约为1,但这并不意味着氢原子的质量就约为1g。相对原子质量是一个比值,它表示的是原子质量与一个碳-12原子质量的$\frac {1}{12}$的比值,而不是原子的实际质量。因此,C选项是错误的。
D选项,相对原子质量确实是一个原子实际质量与一个碳-12原子实际质量的$\frac {1}{12}$的比值,这是相对原子质量的定义,所以D选项是正确的。
【答案】:C
10. (教材图片改编)如图1所示,已知氢原子的相对原子质量约为1,则碳原子的相对原子质量约为
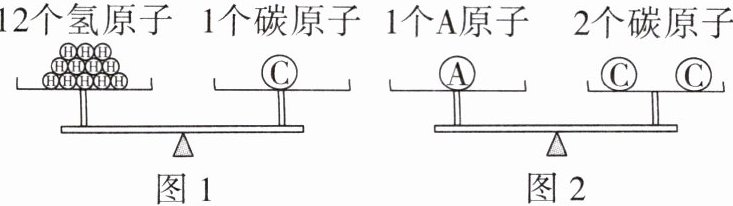
12
;据此认真分析图2,A 原子的相对原子质量约为24
。
答案:
【解析】:
本题可根据相对原子质量的定义以及天平平衡所表示的等量关系来求解。
相对原子质量是以一种碳原子质量的$\frac{1}{12}$为标准,其他原子的质量跟它相比较所得到的比。
从图1可知,12个氢原子的质量等于1个碳原子的质量,已知氢原子的相对原子质量约为1,设碳原子的相对原子质量为$x$,根据相对原子质量的计算关系可得$12×1 = x×\frac{1}{12}$(这里是从相对原子质量与原子实际质量比例关系角度理解,12个氢原子相对质量总和等于1个碳原子相对质量),解得$x = 12$,即碳原子的相对原子质量约为12。
从图2可知,1个A原子的质量等于2个碳原子的质量,因为1个碳原子的相对原子质量约为12,那么2个碳原子的相对原子质量总和为$2×12 = 24$,所以1个A原子的相对原子质量约为24。
【答案】:
12;24
本题可根据相对原子质量的定义以及天平平衡所表示的等量关系来求解。
相对原子质量是以一种碳原子质量的$\frac{1}{12}$为标准,其他原子的质量跟它相比较所得到的比。
从图1可知,12个氢原子的质量等于1个碳原子的质量,已知氢原子的相对原子质量约为1,设碳原子的相对原子质量为$x$,根据相对原子质量的计算关系可得$12×1 = x×\frac{1}{12}$(这里是从相对原子质量与原子实际质量比例关系角度理解,12个氢原子相对质量总和等于1个碳原子相对质量),解得$x = 12$,即碳原子的相对原子质量约为12。
从图2可知,1个A原子的质量等于2个碳原子的质量,因为1个碳原子的相对原子质量约为12,那么2个碳原子的相对原子质量总和为$2×12 = 24$,所以1个A原子的相对原子质量约为24。
【答案】:
12;24
查看更多完整答案,请扫码查看


