第98页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
- 第131页
- 第132页
- 第133页
- 第134页
- 第135页
11.关于“配制50 g溶质质量分数为6%的氯化钠溶液”实验,下列说法错误的是 (
A.称量:用托盘天平称取3 g氯化钠放入烧杯中
B.量取:用50 mL量筒量取水时,俯视读数,所得溶液溶质质量分数偏小
C.溶解:用玻璃棒搅拌的目的是加快氯化钠溶解
D.装瓶:将配制好的溶液装入细口瓶中,塞好瓶塞并贴上标签
B
)A.称量:用托盘天平称取3 g氯化钠放入烧杯中
B.量取:用50 mL量筒量取水时,俯视读数,所得溶液溶质质量分数偏小
C.溶解:用玻璃棒搅拌的目的是加快氯化钠溶解
D.装瓶:将配制好的溶液装入细口瓶中,塞好瓶塞并贴上标签
答案:
B
12.如图为蚀刻时$NF_3$发生反应的微观示意图。下列说法中错误的是 (
A.该反应前后元素的种类不变
B.保持丁物质化学性质的最小微观粒子是氮原子
C.该反应属于置换反应
D.反应生成的丙和丁的分子个数比为3∶2
B
)A.该反应前后元素的种类不变
B.保持丁物质化学性质的最小微观粒子是氮原子
C.该反应属于置换反应
D.反应生成的丙和丁的分子个数比为3∶2
答案:
B 解析:由反应的微观示意图可知,甲为NF₃,乙为Si,丙为SiF₄,丙为N₂;该反应的化学方程式为4NF₃+3Si$\xlongequal{一定条件}$3SiF₄+2N₂。由质量守恒定律可知,反应前后元素的种类不变,A正确;丁是氮气,保持氮气化学性质的最小粒子是氮分子,B错误;该反应是由一种单质与一种化合物作用生成另一种单质与另一种化合物的反应,属于置换反应,C正确;由化学方程式可知,反应生成的丙和丁的分子个数比为3:2,D正确。故本题选B。
13.(2024·无锡期末)在给定条件下,下列物质间的转化能一步实现的是 (
$A. CO_2→H_2CO_3 B. H_2O_2→H_2 C. S→SO_3 D. CuO→Cu$
A
)$A. CO_2→H_2CO_3 B. H_2O_2→H_2 C. S→SO_3 D. CuO→Cu$
答案:
A 解析:二氧化碳和水反应生成碳酸,A正确。过氧化氢在二氧化锰催化作用下分解生成水和氧气,B不正确。硫在氧气中燃烧生成二氧化硫,C不正确。常温下氧化铜不能与碳发生反应,D不正确。故本题选A。
14.茶叶中的单宁酸具有清热解毒等功效,其化学式为C_7_6H_5_2O_4_6,下列说法正确的是 (
A.单宁酸完全燃烧的产物为$CO_2$和$H_2$
B.单宁酸由碳、氢、氧三种元素组成
C.单宁酸中氢元素的质量分数最大
D.单宁酸由碳原子、氢原子、氧原子构成
B
)A.单宁酸完全燃烧的产物为$CO_2$和$H_2$
B.单宁酸由碳、氢、氧三种元素组成
C.单宁酸中氢元素的质量分数最大
D.单宁酸由碳原子、氢原子、氧原子构成
答案:
B 解析:由质量守恒定律可知,化学反应前后元素的种类不变,单宁酸完全燃烧的产物为CO₂和H₂O,A错误。单宁酸是由碳、氢、氧三种元素组成的,B正确。单宁酸中碳、氢、氧三种元素的质量比为(12×76):(1×52):(16×46)=228:13:184,则其中碳元素的质量分数最大,C错误。单宁酸是由单宁酸分子构成的,单宁酸分子由碳原子、氢原子、氧原子构成的,D错误。故本题选B。
15.(2024·盐城东台三模)如图为$MgCl_2、$KCl和$MgSO_4$的溶解度曲线。下列说法正确的是 (
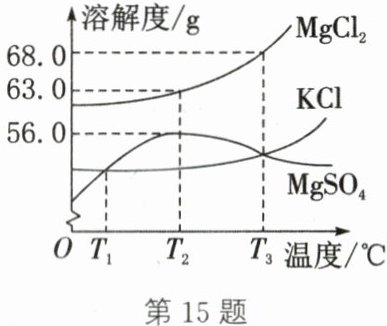
A.三种物质的溶解度都随温度的升高而增大
B.T_2℃$时,将$MgSO_4、$$MgCl_2$固体各60 g分别溶于100 g水,均得到饱和溶液$
C.T_3℃$时,将三种物质的饱和溶液分别降温到$T_2℃,$有两种溶液有晶体析出$
$D.T_1℃$时等质量KCl、$MgSO_4$饱和溶液升温到$T_3℃,$加入等质量对应溶质一定均达到饱和
C
)
A.三种物质的溶解度都随温度的升高而增大
B.T_2℃$时,将$MgSO_4、$$MgCl_2$固体各60 g分别溶于100 g水,均得到饱和溶液$
C.T_3℃$时,将三种物质的饱和溶液分别降温到$T_2℃,$有两种溶液有晶体析出$
$D.T_1℃$时等质量KCl、$MgSO_4$饱和溶液升温到$T_3℃,$加入等质量对应溶质一定均达到饱和
答案:
C 解析:由溶解度曲线可知,氯化镁、氯化钾的溶解度都随温度的升高而增大,而硫酸镁的溶解度随温度的升高先增大后减小,A不正确。T₂℃时,硫酸镁的溶解度是56.0 g,氯化镁的溶解度是63.0 g,在该温度下将MgSO₄和MgCl₂固体各60 g分别溶于100 g水,则形成硫酸镁饱和溶液和氯化镁不饱和溶液,B不正确。T₃℃时,将三种物质的饱和溶液分别降温到T₂℃,有两种溶液有晶体析出,即氯化镁和氯化钾的饱和溶液,因为在该温度范围内,这两种物质的溶解度都随着温度降低而减小,而硫酸镁的溶解度随温度的降低而增大,硫酸镁溶液变为不饱和溶液,溶液中不会有晶体析出,C正确。T₁℃时等质量KCl、MgSO₄饱和溶液升温到T₂℃,均变为不饱和溶液,加入等质量对应溶质不一定均达到饱和,如加入的溶质质量太少时,所得溶液可能仍为不饱和溶液,D不正确。故本题选C。
16.(2023·绥化)向$Cu(NO_3)_2、$$AgNO_3$的混合溶液中加入一定质量的Zn粉和Fe粉的混合物,充分反应后过滤,得到滤渣和无色滤液下列分析正确的 (
B. 滤渣中一定有Ag、Cu,可能有Fe
C. 滤液中一定$Zn(NO_3)_2,$可能有$AgNO_3$
D, 滤液中一定有$Zn(NO_3)_2,$可能有$Fe(NO_3)_2)$
A
)A. 滤渣中一定有Ag、Cu、Fe,可能有ZnB. 滤渣中一定有Ag、Cu,可能有Fe
C. 滤液中一定$Zn(NO_3)_2,$可能有$AgNO_3$
D, 滤液中一定有$Zn(NO_3)_2,$可能有$Fe(NO_3)_2)$
答案:
A 解析:由金属活动性:Zn>Fe>Cu>Ag可知,向Cu(NO₃)₂、AgNO₃的混合溶液中加入一定质量的Zn粉和Fe粉的混合物,锌先与硝酸银溶液反应生成硝酸锌溶液和银,硝酸银反应完全后,若锌有剩余,锌再与硝酸铜溶液反应生成硝酸锌溶液和铜;锌反应完全后,铁才能与硝酸银溶液、硝酸铜溶液反应,生成的硝酸亚铁溶液显浅绿色。充分反应后过滤,得到滤渣和无色滤液,说明滤液中不含硝酸铜、硝酸亚铁,也不可能有硝酸银,由此可推知铁没有参加反应,可能是锌过量,也可能是锌与硝酸铜恰好完全反应,则滤渣中一定有Ag、Cu、Fe,可能有Zn,A正确、B错误。由上述分析可知,滤液中一定有Zn(NO₃)₂,一定没有AgNO₃、Cu(NO₃)₂、Fe(NO₃)₂,C错误、D错误。故本题选A。
17.(2023·苏州)常温下,将10 mL 5%NaOH溶液逐滴加入盛有5 mL 5%稀盐酸(含2滴酚酞溶液)的锥形瓶中,边滴边振荡。下列有关说法正确的是 (
A.滴加过程中,锥形瓶内溶液中Na⁺的数目不断增加
B.滴加过程中,溶液恰好由无色变为红色时,溶液的pH为7
C.滴加过程中,锥形瓶内溶液温度不断升高
D.滴加结束后,取少量溶液蒸干,所得白色固体是NaCl
A
)A.滴加过程中,锥形瓶内溶液中Na⁺的数目不断增加
B.滴加过程中,溶液恰好由无色变为红色时,溶液的pH为7
C.滴加过程中,锥形瓶内溶液温度不断升高
D.滴加结束后,取少量溶液蒸干,所得白色固体是NaCl
答案:
A 解析:氢氧化钠和盐酸反应生成氯化钠和水,该反应的实质是氢离子和氢氧根结合生成水分子,所以滴加过程中,锥形瓶内溶液中Na⁺的数目不断增加,A正确;溶液为红色时,说明滴加的氢氧化钠溶液已过量,此时溶液呈碱性,pH>7,B错误;中和反应放热,反应过程中锥形瓶内溶液温度不断升高,待盐酸完全反应后,再滴加氢氧化钠溶液,溶液温度不再升高,C错误;滴加结束后,由于所加的氢氧化钠已过量,所以取少量溶液蒸干,所得白色固体是NaCl和NaOH的混合物,D错误。故本题选A。
查看更多完整答案,请扫码查看


