第48页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
- 第131页
- 第132页
- 第133页
- 第134页
- 第135页
29.(5分)(2024·南通崇川期中)使用氢能源汽车可以有效减少二氧化碳的排放。氢化钙($\mathrm{CaH}_{2}$)是一种重要的制氢剂,氢化钙可与物质M反应生成氢气,反应的化学方程式为$2\mathrm{M}+\mathrm{CaH}_{2}\xlongequal{\;\;}\mathrm{Ca(OH)}_{2}+2\mathrm{H}_{2}\uparrow$。
(1)$\mathrm{Ca(OH)}_{2}$中氢元素和氧元素的质量比为
(2)M的化学式为
(3)已知某新能源汽车平均使用1 kg氢气可行驶150 km,如果该车氢能源全部来自上述反应,则84 kg $\mathrm{CaH}_{2}$产生的氢气理论上可供这辆汽车行驶多远?
(1)$\mathrm{Ca(OH)}_{2}$中氢元素和氧元素的质量比为
1:16
。(2)M的化学式为
H₂O
。(3)已知某新能源汽车平均使用1 kg氢气可行驶150 km,如果该车氢能源全部来自上述反应,则84 kg $\mathrm{CaH}_{2}$产生的氢气理论上可供这辆汽车行驶多远?
解:设84kg CaH₂产生的氢气质量为x。2H₂O+CaH₂$\xlongequal{\;\;}$Ca(OH)₂+2H₂↑42 484kg x$\frac{42}{4}=\frac{84\mathrm{kg}}{x}$ x=8kg已知某新能源汽车平均使用1kg氢气可行驶150km,则8kg氢气可供这辆汽车行驶150km×8=1200km。答:84kg CaH₂产生的氢气理论上可供这辆汽车行驶1200km。
答案:
(1)1:16 (2)H₂O (3)解:设84kg CaH₂产生的氢气质量为x。2H₂O+CaH₂$\xlongequal{\;\;}$Ca(OH)₂+2H₂↑42 484kg x$\frac{42}{4}=\frac{84\mathrm{kg}}{x}$ x=8kg已知某新能源汽车平均使用1kg氢气可行驶150km,则8kg氢气可供这辆汽车行驶150km×8=1200km。答:84kg CaH₂产生的氢气理论上可供这辆汽车行驶1200km。
30.(6分)市售的食用纯碱中含有少量氯化钠,探究小组以某品牌食用纯碱为样品测定其中$\mathrm{Na}_{2}\mathrm{CO}_{3}$的质量分数,实验过程如图。(已知:碳酸钠的化学式为$\mathrm{Na}_{2}\mathrm{CO}_{3}$,俗称纯碱;$\mathrm{Na}_{2}\mathrm{CO}_{3}+\mathrm{BaCl}_{2}\xlongequal{\;\;}\mathrm{BaCO}_{3}\downarrow+2\mathrm{NaCl}$)
(1)纯碱样品中$\mathrm{Na}_{2}\mathrm{CO}_{3}$的质量分数是多少?(结果精确到0.1%)
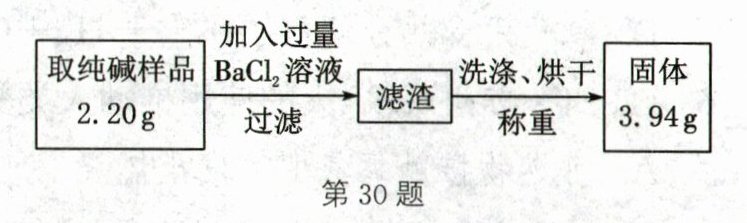
(2)加入过量$\mathrm{BaCl}_{2}$溶液是为了______,如果实验中未洗涤滤渣,导致测定结果______(填“偏大”或“偏小”)。
(1)纯碱样品中$\mathrm{Na}_{2}\mathrm{CO}_{3}$的质量分数是多少?(结果精确到0.1%)

解:设2.20g纯碱样品中Na₂CO₃的质量为x。Na₂CO₃+BaCl₂$\xlongequal{\;\;}$BaCO₃↓+2NaCl106 197x 3.94g$\frac{106}{197}=\frac{x}{3.94\mathrm{g}}$ x=2.12g纯碱样品中Na₂CO₃的质量分数为$\frac{2.12\mathrm{g}}{2.20\mathrm{g}}× 100\%\approx 96.4\%$。答:纯碱样品中Na₂CO₃的质量分数约为96.4%。
(2)加入过量$\mathrm{BaCl}_{2}$溶液是为了______,如果实验中未洗涤滤渣,导致测定结果______(填“偏大”或“偏小”)。
使碳酸钠完全反应
偏大
答案:
(1)解:设2.20g纯碱样品中Na₂CO₃的质量为x。Na₂CO₃+BaCl₂$\xlongequal{\;\;}$BaCO₃↓+2NaCl106 197x 3.94g$\frac{106}{197}=\frac{x}{3.94\mathrm{g}}$ x=2.12g纯碱样品中Na₂CO₃的质量分数为$\frac{2.12\mathrm{g}}{2.20\mathrm{g}}× 100\%\approx 96.4\%$。答:纯碱样品中Na₂CO₃的质量分数约为96.4%。(2)使碳酸钠完全反应 偏大 解析:
(2)加入过量BaCl₂溶液是为了使碳酸钠完全反应,使测定结果更准确;如果实验中未洗涤滤渣,滤渣表面有残留的氯化钠溶液,烘干后,会导致固体质量增加,使测定结果偏大。
(2)加入过量BaCl₂溶液是为了使碳酸钠完全反应,使测定结果更准确;如果实验中未洗涤滤渣,滤渣表面有残留的氯化钠溶液,烘干后,会导致固体质量增加,使测定结果偏大。
查看更多完整答案,请扫码查看


