第131页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
- 第131页
- 第132页
- 第133页
- 第134页
- 第135页
21. (14 分)(2025·南通海门期中)活性$Al_{2}O_{3}$被广泛地用作化学反应的催化剂和催化剂载体。
Ⅰ. 采用水解法生产高纯$Al_{2}O_{3}$的主要工艺流程如图甲,已知:氢氧化铝难溶于水。
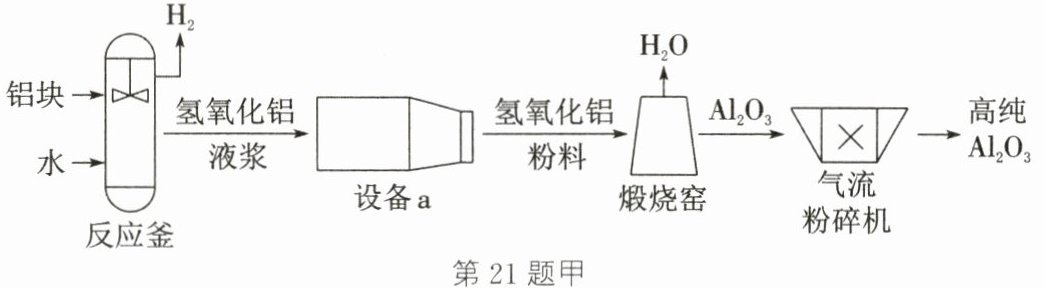
(1) 反应釜中活化的铝与水在加热条件下反应生成氢氧化铝和$H_{2}$,写出该反应的化学方程式:
(2) 设备 a 可将氢氧化铝固体与液体杂质分离,其中的操作名称为
(3) 煅烧窑中发生反应的基本类型为
(4) 气流粉碎机中发生的变化属于
Ⅱ. 硫酸铝晶体[$Al_{2}(SO_{4})_{3}\cdot 18H_{2}O$,相对分子质量为 666]也可以分解得到活性$Al_{2}O_{3}$。将 33.3g 硫酸铝晶体放在坩埚内加热,固体质量与成分随温度变化的曲线如图乙。已知$425^{\circ }C$前减少的均为结晶水的质量。
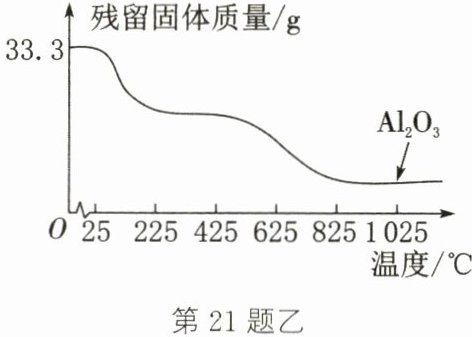
(5) 加热至$530^{\circ }C$时,$Al_{2}(SO_{4})_{3}$开始分解,生成$Al_{2}O_{3}$与一种氧化物,且反应前后元素的化合价均未发生变化,则该氧化物为
(6) 理论上 33.3g 硫酸铝晶体最多可制得$Al_{2}O_{3}$的质量为
Ⅰ. 采用水解法生产高纯$Al_{2}O_{3}$的主要工艺流程如图甲,已知:氢氧化铝难溶于水。

(1) 反应釜中活化的铝与水在加热条件下反应生成氢氧化铝和$H_{2}$,写出该反应的化学方程式:
2Al + 6H₂O△2Al(OH)₃ + 3H₂↑
。为加快该反应,除升高温度外,还可以采取的措施有搅拌(或将铝块粉碎等合理答案均可)
。(2) 设备 a 可将氢氧化铝固体与液体杂质分离,其中的操作名称为
过滤
。(3) 煅烧窑中发生反应的基本类型为
分解反应
。(4) 气流粉碎机中发生的变化属于
物理
(填“物理”或“化学”)变化。Ⅱ. 硫酸铝晶体[$Al_{2}(SO_{4})_{3}\cdot 18H_{2}O$,相对分子质量为 666]也可以分解得到活性$Al_{2}O_{3}$。将 33.3g 硫酸铝晶体放在坩埚内加热,固体质量与成分随温度变化的曲线如图乙。已知$425^{\circ }C$前减少的均为结晶水的质量。

(5) 加热至$530^{\circ }C$时,$Al_{2}(SO_{4})_{3}$开始分解,生成$Al_{2}O_{3}$与一种氧化物,且反应前后元素的化合价均未发生变化,则该氧化物为
SO₃
(填化学式)。(6) 理论上 33.3g 硫酸铝晶体最多可制得$Al_{2}O_{3}$的质量为
5.1
g。
答案:
(1)2Al + 6H₂O△2Al(OH)₃ + 3H₂↑ 搅拌(或将铝块粉碎等合理答案均可) (2)过滤 (3)分解反应(4)物理 (5)SO₃ (6)5.1
22. (2025·西安雁塔期中)质量守恒定律是自然界最普遍、最重要的基本定律之一。某化学课外小组同学用如图所示实验探究质量守恒定律。
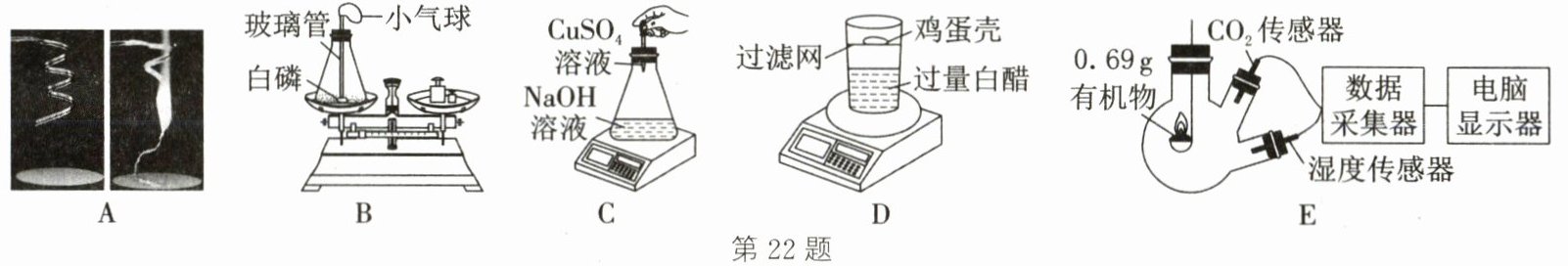
【实验验证】
(1) 某同学在 A 组实验中用镁条在空气中燃烧来探究质量守恒定律,反应的化学方程式为
(2) B 组实验中,同学们发现待白磷熄灭后再次称量装置和药品的总质量时,有时天平不平衡,其原因可能是
A. 橡皮塞没塞紧
B. 白磷的量不足
C. 没有等锥形瓶冷却就开始称量
(3) A、B、C 三组实验装置中可以直接验证质量守恒定律的是
【结论解释】(4) 由质量守恒定律可知,化学反应前后一定不变的是
① 原子种类 ② 原子数目 ③ 原子质量 ④ 分子种类 ⑤ 元素种类 ⑥ 分子个数
【反思拓展】(5) 某化学兴趣小组查阅资料:白醋能与鸡蛋壳反应生成二氧化碳气体,同学们利用内有过滤网的带盖塑料杯,设计如图 D 实验验证质量守恒定律。实验前药品和装置的总质量为$m_{1}$,倒立杯子充分反应后称量总质量为$m_{2}$,打开杯盖后称量总质量为$m_{3}$,三者之间的大小关系为
【迁移应用】(6) 根据质量守恒定律,能从定性和定量的视角研究物质的组成及变化。某数字化实验小组的同学在密闭容器中用$CO_{2}$传感器和湿度传感器探究某有机物 R 的元素组成,实验装置如图 E 所示。实验前 R 的质量为 0.69g,燃烧后经过数据换算可得装置中$CO_{2}$的质量为 0.88g,$H_{2}O$的质量为 0.81g(本实验条件下空气中$CO_{2}和H_{2}O$的含量忽略不计)。下列说法不正确的是
A. 物质 R 中 C、H 元素的质量比一定为$8:3$
B. 本实验不能推算 R 中是否含有氧元素
C. 随着反应的进行,密闭容器内氧气的浓度降低
D. 若 R 为$C_{2}H_{6}O$,则实验中 R 一定没有剩余

【实验验证】
(1) 某同学在 A 组实验中用镁条在空气中燃烧来探究质量守恒定律,反应的化学方程式为
2Mg + O₂点燃2MgO
。(2) B 组实验中,同学们发现待白磷熄灭后再次称量装置和药品的总质量时,有时天平不平衡,其原因可能是
AC
(填字母)。A. 橡皮塞没塞紧
B. 白磷的量不足
C. 没有等锥形瓶冷却就开始称量
(3) A、B、C 三组实验装置中可以直接验证质量守恒定律的是
BC
(填字母)。【结论解释】(4) 由质量守恒定律可知,化学反应前后一定不变的是
①②③⑤
(填序号)。① 原子种类 ② 原子数目 ③ 原子质量 ④ 分子种类 ⑤ 元素种类 ⑥ 分子个数
【反思拓展】(5) 某化学兴趣小组查阅资料:白醋能与鸡蛋壳反应生成二氧化碳气体,同学们利用内有过滤网的带盖塑料杯,设计如图 D 实验验证质量守恒定律。实验前药品和装置的总质量为$m_{1}$,倒立杯子充分反应后称量总质量为$m_{2}$,打开杯盖后称量总质量为$m_{3}$,三者之间的大小关系为
m₁ = m₂ > m₃
。【迁移应用】(6) 根据质量守恒定律,能从定性和定量的视角研究物质的组成及变化。某数字化实验小组的同学在密闭容器中用$CO_{2}$传感器和湿度传感器探究某有机物 R 的元素组成,实验装置如图 E 所示。实验前 R 的质量为 0.69g,燃烧后经过数据换算可得装置中$CO_{2}$的质量为 0.88g,$H_{2}O$的质量为 0.81g(本实验条件下空气中$CO_{2}和H_{2}O$的含量忽略不计)。下列说法不正确的是
A
(填字母)。A. 物质 R 中 C、H 元素的质量比一定为$8:3$
B. 本实验不能推算 R 中是否含有氧元素
C. 随着反应的进行,密闭容器内氧气的浓度降低
D. 若 R 为$C_{2}H_{6}O$,则实验中 R 一定没有剩余
答案:
(1)2Mg + O₂点燃2MgO (2)AC (3)BC(4)①②③⑤ (5)m₁ = m₂ > m₃ (6)A
查看更多完整答案,请扫码查看


