第40页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
- 第131页
- 第132页
- 第133页
- 第134页
- 第135页
23.(6分)新素养 跨学科实践 如图为家用燃料的发展历程:
(1)柴草燃烧时
(2)家庭用煤经历从“煤球”到“蜂窝煤”的变化,这种变化的优点是
(3)液化石油气$(C_{3}H_{8})$完全燃烧的化学方程式为
(4)已知相同条件下气体体积比等于分子个数比。若原来使用管道煤气的灶具改用天然气,进气管的风门不变,则应将进空气管的风门调
(5)掺氢天然气能改善天然气的品质。某掺氢天然气(假设该混合气仅含$CH_{4}和H_{2}$)中氢元素的质量分数为40%。混合气体充分燃烧后生成$H_{2}O和CO_{2}$的质量比为
(6)未来家用燃料在选择时需考虑的因素有
(1)柴草燃烧时
化学
能转化为内能和光能。(2)家庭用煤经历从“煤球”到“蜂窝煤”的变化,这种变化的优点是
增大了煤与空气的接触面积,使煤燃烧得更充分(合理答案均可)
。(3)液化石油气$(C_{3}H_{8})$完全燃烧的化学方程式为
C₃H₈+5O₂$\frac{\underline{\;点燃\;}}{\;}$3CO₂+4H₂O
。(4)已知相同条件下气体体积比等于分子个数比。若原来使用管道煤气的灶具改用天然气,进气管的风门不变,则应将进空气管的风门调
大
(填“大”或“小”)。(5)掺氢天然气能改善天然气的品质。某掺氢天然气(假设该混合气仅含$CH_{4}和H_{2}$)中氢元素的质量分数为40%。混合气体充分燃烧后生成$H_{2}O和CO_{2}$的质量比为
18:11
(填最简整数比)。(6)未来家用燃料在选择时需考虑的因素有
安全环保(合理答案均可)
(任写一条)。
答案:
(1)化学
(2)增大了煤与空气的接触面积,使煤燃烧得更充分(合理答案均可)
(3)C₃H₈+5O₂$\frac{\underline{\;点燃\;}}{\;}$3CO₂+4H₂O
(4)大
(5)18:11
(6)安全环保(合理答案均可)
解析:
(3)液化石油气(C₃H₈)完全燃烧生成二氧化碳和水,反应的化学方程式为C₃H₈+5O₂$\frac{\underline{\;点燃\;}}{\;}$3CO₂+4H₂O。
(4)管道煤气的主要成分是CO、H₂,天然气的主要成分是CH₄,由化学方程式2CO+O₂$\frac{\underline{\;点燃\;}}{\;}$2CO₂、2H₂+O₂$\frac{\underline{\;点燃\;}}{\;}$2H₂O、CH₄+2O₂$\frac{\underline{\;点燃\;}}{\;}$CO₂+2H₂O中的微观粒子个数比可知,充分燃烧相同体积的管道煤气和天然气时,耗氧气较多的是天然气,则原来使用管道煤气的灶具改用天然气时,进气管的风门不变,则应将进空气管的风门调大。
(5)设混合气体的质量为100g,则其中含氢元素的质量为100g×40%=40g,含碳元素的质量为100g−40g=60g,由质量守恒定律可知,混合气体充分燃烧后生成水的质量为$\frac{40g}{\frac{2}{18}×100\%}$=360g,生成二氧化碳的质量为$\frac{60g}{\frac{12}{44}×100\%}$=220g,则混合气体充分燃烧后生成H₂O和CO₂的质量比为360g:220g=18:11。
(6)未来家用燃料在选择时需考虑的因素有安全环保等。
(1)化学
(2)增大了煤与空气的接触面积,使煤燃烧得更充分(合理答案均可)
(3)C₃H₈+5O₂$\frac{\underline{\;点燃\;}}{\;}$3CO₂+4H₂O
(4)大
(5)18:11
(6)安全环保(合理答案均可)
解析:
(3)液化石油气(C₃H₈)完全燃烧生成二氧化碳和水,反应的化学方程式为C₃H₈+5O₂$\frac{\underline{\;点燃\;}}{\;}$3CO₂+4H₂O。
(4)管道煤气的主要成分是CO、H₂,天然气的主要成分是CH₄,由化学方程式2CO+O₂$\frac{\underline{\;点燃\;}}{\;}$2CO₂、2H₂+O₂$\frac{\underline{\;点燃\;}}{\;}$2H₂O、CH₄+2O₂$\frac{\underline{\;点燃\;}}{\;}$CO₂+2H₂O中的微观粒子个数比可知,充分燃烧相同体积的管道煤气和天然气时,耗氧气较多的是天然气,则原来使用管道煤气的灶具改用天然气时,进气管的风门不变,则应将进空气管的风门调大。
(5)设混合气体的质量为100g,则其中含氢元素的质量为100g×40%=40g,含碳元素的质量为100g−40g=60g,由质量守恒定律可知,混合气体充分燃烧后生成水的质量为$\frac{40g}{\frac{2}{18}×100\%}$=360g,生成二氧化碳的质量为$\frac{60g}{\frac{12}{44}×100\%}$=220g,则混合气体充分燃烧后生成H₂O和CO₂的质量比为360g:220g=18:11。
(6)未来家用燃料在选择时需考虑的因素有安全环保等。
24.(5分)从微观和宏观两方面研究质量守恒定律对化学学科发展具有重大意义。
(1)在氧气中点燃红磷的实验过程,固体质量变化如图甲所示。
① 红磷在$t_{1}s$
② 红磷燃烧生成五氧化二磷,该反应的化学方程式为
③ 参加反应的氧气的质量为
(2)从化合价和物质类别两个维度认识元素及其化合物性质是重要的化学学习方式。如图乙所示是碳元素的化合价与物质类别的关系图。
① A的物质类别是
② A燃烧能生成B,该反应的化学方程式为
(1)在氧气中点燃红磷的实验过程,固体质量变化如图甲所示。
① 红磷在$t_{1}s$
后
(填“前”或“后”)开始燃烧。② 红磷燃烧生成五氧化二磷,该反应的化学方程式为
4P+5O₂$\frac{\underline{\;点燃\;}}{\;}$2P₂O₅
。③ 参加反应的氧气的质量为
8.0
g(结果保留一位小数)。(2)从化合价和物质类别两个维度认识元素及其化合物性质是重要的化学学习方式。如图乙所示是碳元素的化合价与物质类别的关系图。
① A的物质类别是
单质
。② A燃烧能生成B,该反应的化学方程式为
C+O₂$\frac{\underline{\;点燃\;}}{\;}$CO₂
。
答案:
(1)①后 ②4P+5O₂$\frac{\underline{\;点燃\;}}{\;}$2P₂O₅ ③8.0
(2)①单质 ②C+O₂$\frac{\underline{\;点燃\;}}{\;}$CO₂
(1)①后 ②4P+5O₂$\frac{\underline{\;点燃\;}}{\;}$2P₂O₅ ③8.0
(2)①单质 ②C+O₂$\frac{\underline{\;点燃\;}}{\;}$CO₂
25.(4分)“宏微结合”是化学学科核心素养之一。某物质在点燃的条件下发生反应,生成物和反应物共四种,它们的微观示意图和反应前后的质量如表所示。
(1)由“ ”构成的物质中,“
”构成的物质中,“ ”所代表的元素的化合价为______
”所代表的元素的化合价为______
(2)表中的四种物质中,属于氧化物的是______
(3)上述反应的化学方程式为______
(4)某同学在计算反应物和生成物之间的质量关系时,可得出$x+y= $______
(1)由“
 ”构成的物质中,“
”构成的物质中,“ ”所代表的元素的化合价为______
”所代表的元素的化合价为______0
。(2)表中的四种物质中,属于氧化物的是______
CO₂、H₂O
(填化学式)。(3)上述反应的化学方程式为______
CH₄+2O₂$\frac{\underline{\;点燃\;}}{\;}$CO₂+2H₂O
。(4)某同学在计算反应物和生成物之间的质量关系时,可得出$x+y= $______
72
。
答案:
(1)0
(2)CO₂、H₂O
(3)CH₄+2O₂$\frac{\underline{\;点燃\;}}{\;}$CO₂+2H₂O
(4)72
解析:
(1)由微观示意图可知, 是O₂,单质中元素化合价为0。
(2)甲、乙、丙、丁四种物质的化学式分别为CH₄、O₂、CO₂、H₂O,其中CO₂、H₂O属于氧化物。
(3)该反应是CH₄和O₂在点燃的条件下反应生成CO₂和H₂O,化学方程式为CH₄+2O₂$\frac{\underline{\;点燃\;}}{\;}$CO₂+2H₂O。
(4)由质量守恒定律可知,化学反应前后物质的总质量不变,因此,16+100+1+0=0+x+45+y,解得x+y=72。
(1)0
(2)CO₂、H₂O
(3)CH₄+2O₂$\frac{\underline{\;点燃\;}}{\;}$CO₂+2H₂O
(4)72
解析:
(1)由微观示意图可知, 是O₂,单质中元素化合价为0。
(2)甲、乙、丙、丁四种物质的化学式分别为CH₄、O₂、CO₂、H₂O,其中CO₂、H₂O属于氧化物。
(3)该反应是CH₄和O₂在点燃的条件下反应生成CO₂和H₂O,化学方程式为CH₄+2O₂$\frac{\underline{\;点燃\;}}{\;}$CO₂+2H₂O。
(4)由质量守恒定律可知,化学反应前后物质的总质量不变,因此,16+100+1+0=0+x+45+y,解得x+y=72。
26.(5分)(2025·南宁段考)二氧化氯$(ClO_{2})$是一种高效、广谱、安全的消毒剂,在生产、生活中广泛使用。以氯化钠溶液为原料,制取$ClO_{2}$的工艺流程如图所示。
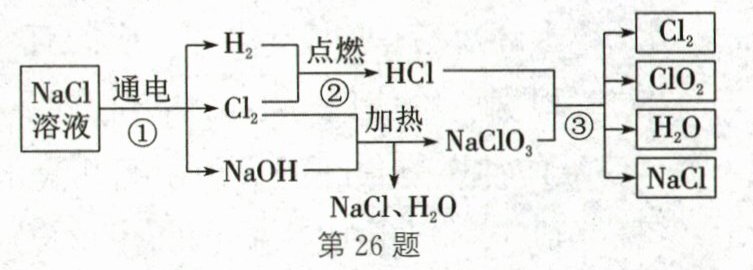
查阅资料:氯气是一种黄绿色的有毒气体。
(1)氯化钠溶液通电时发生反应的化学方程式为
(2)反应②属于
(3)有元素化合价升降的反应称为氧化还原反应。在氧化还原反应中,所含元素化合价升高的反应物为还原剂,所含元素化合价降低的反应物为氧化剂。反应③中的氧化剂是
(4)“绿色化学”提倡物质循环利用,该工艺流程中可以循环利用的物质除了水还有
(5)利用该工艺生产$ClO_{2}$,废气处理十分重要,是因为

查阅资料:氯气是一种黄绿色的有毒气体。
(1)氯化钠溶液通电时发生反应的化学方程式为
2NaCl+2H₂O$\frac{\underline{\;通电\;}}{\;}$H₂↑+Cl₂↑+2NaOH
。(2)反应②属于
化合反应
(填基本反应类型)。(3)有元素化合价升降的反应称为氧化还原反应。在氧化还原反应中,所含元素化合价升高的反应物为还原剂,所含元素化合价降低的反应物为氧化剂。反应③中的氧化剂是
NaClO₃
(填化学式)。(4)“绿色化学”提倡物质循环利用,该工艺流程中可以循环利用的物质除了水还有
NaCl、Cl₂
(填化学式)。(5)利用该工艺生产$ClO_{2}$,废气处理十分重要,是因为
氯气是有毒气体,直接排放会污染环境,甚至会对人体造成伤害
。
答案:
(1)2NaCl+2H₂O$\frac{\underline{\;通电\;}}{\;}$H₂↑+Cl₂↑+2NaOH
(2)化合反应
(3)NaClO₃
(4)NaCl、Cl₂
(5)氯气是有毒气体,直接排放会污染环境,甚至会对人体造成伤害
解析:
(1)根据质量守恒定律,化学反应前后元素的种类不变,生成物中有氢气、氯气和氢氧化钠,含有氢、氯、氧、钠四种元素,则反应物中应有水,所以发生的反应是氯化钠和水在通电条件下反应生成氢气、氯气和氢氧化钠,化学方程式为2NaCl+2H₂O$\frac{\underline{\;通电\;}}{\;}$H₂↑+Cl₂↑+2NaOH。
(2)反应②为氢气和氯气在点燃条件下反应生成氯化氢,该反应符合“多变一”的特点,属于化合反应。
(3)由题意可知,所含元素化合价降低的反应物为氧化剂。反应③的反应物HCl中Cl元素的化合价为−1;NaClO₃中Na元素的化合价为+1,O元素的化合价为−2,根据化合物中各元素正、负化合价代数和为0,Cl元素的化合价为+5。反应③的生成物Cl₂中Cl元素的化合价为0,NaCl中Cl元素的化合价为−1,ClO₂中Cl元素的化合价为+4,所以只有NaClO₃中氯元素的化合价降低了,故反应③中NaClO₃是氧化剂。
(4)由题图可知,反应①中氯化钠为反应物,反应③有氯化钠生成,且氯气和氢氧化钠反应也生成氯化钠,故氯化钠可循环利用,化学式为NaCl;反应①中生成的氯气可作为后续反应的反应物,反应③生成氯气,故氯气可循环利用,化学式为Cl₂。
(5)通过流程图可知,最终生成物中有氯气,氯气是一种黄绿色的有毒气体,直接排放会污染环境,甚至会对人体造成伤害,所以废气处理十分重要。
(1)2NaCl+2H₂O$\frac{\underline{\;通电\;}}{\;}$H₂↑+Cl₂↑+2NaOH
(2)化合反应
(3)NaClO₃
(4)NaCl、Cl₂
(5)氯气是有毒气体,直接排放会污染环境,甚至会对人体造成伤害
解析:
(1)根据质量守恒定律,化学反应前后元素的种类不变,生成物中有氢气、氯气和氢氧化钠,含有氢、氯、氧、钠四种元素,则反应物中应有水,所以发生的反应是氯化钠和水在通电条件下反应生成氢气、氯气和氢氧化钠,化学方程式为2NaCl+2H₂O$\frac{\underline{\;通电\;}}{\;}$H₂↑+Cl₂↑+2NaOH。
(2)反应②为氢气和氯气在点燃条件下反应生成氯化氢,该反应符合“多变一”的特点,属于化合反应。
(3)由题意可知,所含元素化合价降低的反应物为氧化剂。反应③的反应物HCl中Cl元素的化合价为−1;NaClO₃中Na元素的化合价为+1,O元素的化合价为−2,根据化合物中各元素正、负化合价代数和为0,Cl元素的化合价为+5。反应③的生成物Cl₂中Cl元素的化合价为0,NaCl中Cl元素的化合价为−1,ClO₂中Cl元素的化合价为+4,所以只有NaClO₃中氯元素的化合价降低了,故反应③中NaClO₃是氧化剂。
(4)由题图可知,反应①中氯化钠为反应物,反应③有氯化钠生成,且氯气和氢氧化钠反应也生成氯化钠,故氯化钠可循环利用,化学式为NaCl;反应①中生成的氯气可作为后续反应的反应物,反应③生成氯气,故氯气可循环利用,化学式为Cl₂。
(5)通过流程图可知,最终生成物中有氯气,氯气是一种黄绿色的有毒气体,直接排放会污染环境,甚至会对人体造成伤害,所以废气处理十分重要。
查看更多完整答案,请扫码查看


