第63页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
- 第131页
- 第132页
- 第133页
- 第134页
- 第135页
18.如图所示,天平两端的烧杯中分别盛有质量和浓度均相同的稀硫酸,调整天平平衡后,同时向天平两端的烧杯中分别加入等质量的锌粒和铁粒。下列情况不可能出现的是(
A.反应时天平指针先向右偏转
B.反应结束后天平指针居中
C.反应结束后天平指针偏左
D.反应结束后天平指针偏右
D
)A.反应时天平指针先向右偏转
B.反应结束后天平指针居中
C.反应结束后天平指针偏左
D.反应结束后天平指针偏右
答案:
D 解析:锌的化学性质比铁活泼,反应开始时左端产生氢气快,故天平指针先向右偏转。如果稀硫酸完全反应,且加入的金属质量也相等,那么左右两端产生的氢气的质量相等,反应结束后天平指针居中。若稀硫酸过量,设锌粒和铁粒的质量为x,产生的氢气的质量分别是y、z。Zn+H₂SO₄ZnSO₄+H₂↑65 2x y65/2=x/y y=2x/65Fe+H₂SO₄FeSO₄+H₂↑56 2x z56/2=x/z z=2x/56因为y/z<1,左端产生的氢气质量小于右端,所以反应结束后天平指针偏左。
19.(2024·南阳新野期末)由两种金属组成的5.6 g混合物与足量稀盐酸完全反应后得0.24 g氢气,则该金属混合物的组成可能是(
A.铁和锌
B.铝和镁
C.镁和锌
D.铁和铜
C
)A.铁和锌
B.铝和镁
C.镁和锌
D.铁和铜
答案:
C 解析:锌与稀盐酸反应生成氯化锌和氢气,参加反应的锌与生成的氢气的质量比为65:2;镁与稀盐酸反应生成氯化镁和氢气,参加反应的镁与生成的氢气的质量比为24:2;铁与稀盐酸反应生成氯化亚铁和氢气,参加反应的铁与生成的氢气的质量比为56:2;铝与稀盐酸反应生成氯化铝和氢气,参加反应的铝与生成的氢气的质量比为54:6=18:2。假设锌、镁、铁、铝在与酸反应时都看作+2价金属,则各金属的相对原子质量分别为锌:65;镁:24;铁:56;铝:18。设某金属的元素符号为M,该金属的相对原子质量为x,则M +2HClMCl₂+H₂↑x 25.6 g 0.24 gx/2=5.6 g/0.24 g x≈47Fe的相对原子质量为56、Zn的相对原子质量为65,由铁和锌组成的金属混合物的平均相对原子质量大于47,A错误;Al看作+2价金属时的相对原子质量为18、Mg的相对原子质量为24,由铝和镁组成的金属混合物的平均相对原子质量小于47,B错误;Mg的相对原子质量为24、Zn的相对原子质量为65,由镁和锌组成的金属混合物的平均相对原子质量可能为47,C正确;Fe的相对原子质量为56,铜不能与稀盐酸反应生成氢气,由铁和铜组成的金属混合物的平均相对原子质量大于47,D错误。
20.(2025·南京期末)将一氧化碳和铁的氧化物FeₓOᵧ置于密闭容器中,一定条件下充分反应。反应过程中容器内部分物质的质量变化如图所示,横坐标表示$CO_2$的质量,纵坐标既可以表示CO的质量,也可以表示Fe的质量。下列说法正确的是(
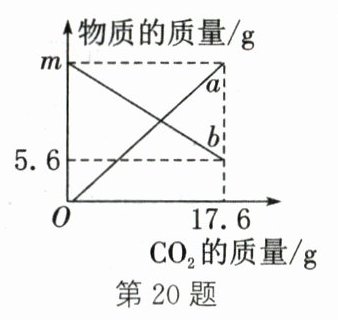
A.曲线a表示CO的质量变化,曲线b表示Fe的质量变化
B.m的值为19.6,充分反应后参加反应的铁的氧化物的质量为16 g
C.当$CO_2$的质量为4.4 g时,容器内CO的质量为14 g
D.铁的氧化物中x:y= 2:3
C
)
A.曲线a表示CO的质量变化,曲线b表示Fe的质量变化
B.m的值为19.6,充分反应后参加反应的铁的氧化物的质量为16 g
C.当$CO_2$的质量为4.4 g时,容器内CO的质量为14 g
D.铁的氧化物中x:y= 2:3
答案:
C 解析:由图示可知,完全反应后生成二氧化碳的质量为17.6 g,17.6 g二氧化碳中碳元素的质量为17.6 g×(12/44×100%)=4.8 g,根据质量守恒定律,化学反应前后元素的种类和质量不变,则反应前碳元素的质量也为4.8 g,反应前碳元素都来自一氧化碳,所以参加反应的一氧化碳的质量为4.8 g/(12/28×100%)=11.2 g,由于一氧化碳是反应物,反应过程中质量逐渐减小,所以反应前一氧化碳的质量为m g,反应后剩余一氧化碳的质量为5.6 g,参加反应的一氧化碳的质量为11.2 g,则反应前一氧化碳的质量为5.6 g+11.2 g=16.8 g,即m=16.8,由于铁是生成物,反应过程中质量从0逐渐增大,则生成铁的质量也是16.8 g。由以上分析可知,曲线a表示铁的质量变化,曲线b表示一氧化碳的质量变化,A不正确。m的值为16.8,该反应是11.2 g一氧化碳和铁的氧化物反应生成17.6 g二氧化碳和16.8 g铁,根据质量守恒定律,化学反应前后物质的总质量不变,则充分反应后参加反应的铁的氧化物的质量为17.6 g+16.8 g-11.2 g=23.2 g,B不正确。充分反应后共生成17.6 g二氧化碳,当CO₂的质量为4.4 g时,生成二氧化碳的质量占二氧化碳总质量的四分之一,则容器内CO的质量为16.8 g-11.2 g×1/4=14 g,C正确。铁的氧化物中铁元素的质量为16.8 g,氧元素的质量为17.6 g-11.2 g=6.4 g,则铁的氧化物中铁元素与氧元素的原子个数比为16.8 g/56:6.4 g/16=3:4,即x:y=3:4,D不正确。
21.(4分)金属材料在生活、生产中应用极其广泛。
(1)为了方便出行,街面上出现了大量的"小黄车"(如图),这种共享单车所用的材料中属于金属材料的是
a. 塑料把手 b. 钢车架 c. 铝合金轮毂 d. 橡胶轮胎

(2)这种共享单车的链条具有的性质是
a. 密度大、熔点高 b. 强度高、耐磨 c. 光泽好、可塑性好
(3)电动"小黄车"使用的是锂电池,其工作原理是锂在一定条件下与二氧化锰发生化合反应生成$LiMnO_2,$该反应的化学方程式为
(1)为了方便出行,街面上出现了大量的"小黄车"(如图),这种共享单车所用的材料中属于金属材料的是
bc
(填字母)。a. 塑料把手 b. 钢车架 c. 铝合金轮毂 d. 橡胶轮胎

(2)这种共享单车的链条具有的性质是
b
(填字母)。a. 密度大、熔点高 b. 强度高、耐磨 c. 光泽好、可塑性好
(3)电动"小黄车"使用的是锂电池,其工作原理是锂在一定条件下与二氧化锰发生化合反应生成$LiMnO_2,$该反应的化学方程式为
Li+MnO₂$\stackrel{一定条件}{=}$LiMnO₂
,反应后锰元素的化合价为+3
。
答案:
(1)bc (2)b (3)Li+MnO₂一定条件LiMnO₂ +3
22.(8分)(2025·苏州姑苏期末)金属单质及其化合物在材料中发挥着重要作用。
(1)①日常生活中,适合制作电缆的金属是
A. 金 B. 铜 C. 汞 D. 钨
②铋、铅、锡和镉的熔点分别为271℃、327℃、232℃和321℃。由这四种金属制成的武德合金(用作保险丝材料)的熔点
A. 高于327℃ B. 低于232℃ C. 在232~327℃之间
(2)福建号航母在建造过程中需使用大量特种钢。
①特种钢属于
②舰体甲板用于起降舰载机,舰载机喷出的尾焰温度高达数千度。甲板所用特种钢除了硬度大,还需具备的物理特性是
(3)烧制青砖时,需隔绝空气使其冷却,防止高温下青砖中的FeO与$O_2$反应。
①高温下,FeO与$O_2$反应生成氧化铁的化学方程式为
②上述过程中,铁元素化合价发生的变化为
(4)MgₙCu是一种储氢合金。350℃时,MgₙCu与$H_2$反应生成$MgH_2。$
①MgₙCu中Mg与Cu的质量比为3:4,则n=
$②MgH_2$中氢元素的质量分数约为
(1)①日常生活中,适合制作电缆的金属是
B
(填字母)。A. 金 B. 铜 C. 汞 D. 钨
②铋、铅、锡和镉的熔点分别为271℃、327℃、232℃和321℃。由这四种金属制成的武德合金(用作保险丝材料)的熔点
B
(填字母)。A. 高于327℃ B. 低于232℃ C. 在232~327℃之间
(2)福建号航母在建造过程中需使用大量特种钢。
①特种钢属于
混合物
(填"纯净物"或"混合物")。②舰体甲板用于起降舰载机,舰载机喷出的尾焰温度高达数千度。甲板所用特种钢除了硬度大,还需具备的物理特性是
耐高温
(写一种即可)。(3)烧制青砖时,需隔绝空气使其冷却,防止高温下青砖中的FeO与$O_2$反应。
①高温下,FeO与$O_2$反应生成氧化铁的化学方程式为
4FeO+O₂高温2Fe₂O₃
。②上述过程中,铁元素化合价发生的变化为
由+2变为+3
。(4)MgₙCu是一种储氢合金。350℃时,MgₙCu与$H_2$反应生成$MgH_2。$
①MgₙCu中Mg与Cu的质量比为3:4,则n=
2
。$②MgH_2$中氢元素的质量分数约为
7.7%
(结果精确到0.1%)。
答案:
(1)① B ② B (2)① 混合物 ② 耐高温(合理答案均可) (3)① 4FeO+O₂高温2Fe₂O₃ ② 由+2变为+3 (4)① 2 ② 7.7% 解析:(4)① MgₙCu中Mg与Cu的质量比为3:4,则24n/64=3/4,解得n=2。② MgH₂中氢元素的质量分数为(1×2)/(24+1×2)×100%≈7.7%。
查看更多完整答案,请扫码查看


