第75页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
- 第131页
- 第132页
- 第133页
- 第134页
- 第135页
18.向一定温度、一定量的饱和氢氧化钙溶液中加入少量的氧化钙,下列图像符合实际的是(
B
)
答案:
B 解析:向一定温度、一定量的饱和氢氧化钙溶液中加入少量的氧化钙,氧化钙与水反应生成氢氧化钙,同时放出热量,使溶液温度升高。氢氧化钙的溶解度随温度升高而减小,同时溶液中的溶剂减少,均会导致氢氧化钙析出,溶质质量减小,溶液质量减小;反应结束后,温度逐渐恢复至室温(与反应前相同),氢氧化钙的溶解度随着温度的降低而增大,氢氧化钙的溶解度增大,溶液中溶质质量又开始增大,由于溶剂减少,所以最终溶液质量一定比反应前小,A、D错误,B正确。反应放出大量的热,氢氧化钙的溶解度减小,溶质质量分数减小;反应结束后,温度恢复至室温,氢氧化钙的溶解度逐渐增大,溶液的溶质质量分数逐渐增大至与反应前相等,C错误。
19.(2024·镇江)NaCl和$Na_2SO_4$的溶解度表及溶解度曲线如下。下列说法正确的是(
|温度/℃|10|20|30|40|50|60|
|溶解度/g|NaCl|35.8|35.9|36.3|36.6|37|37.3|
||$Na_2SO_4$|9.1|19.5|40.8|48.8|45.3|43.7|
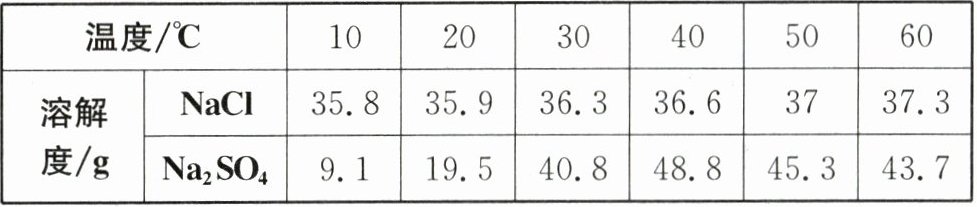
A.甲为NaCl
$B.T_1℃$应介于40~50℃之间
C.甲、乙的饱和溶液从$T_3℃$降温到$T_2℃,$溶质的质量分数:甲变大、乙变小
D.等质量的NaCl、$Na_2SO_4$饱和溶液从$T_1℃$升温到$T_3℃,$要使两溶液均达饱和,则加入$Na_2SO_4$的质量大于NaCl的质量
D
)|温度/℃|10|20|30|40|50|60|
|溶解度/g|NaCl|35.8|35.9|36.3|36.6|37|37.3|
||$Na_2SO_4$|9.1|19.5|40.8|48.8|45.3|43.7|


A.甲为NaCl
$B.T_1℃$应介于40~50℃之间
C.甲、乙的饱和溶液从$T_3℃$降温到$T_2℃,$溶质的质量分数:甲变大、乙变小
D.等质量的NaCl、$Na_2SO_4$饱和溶液从$T_1℃$升温到$T_3℃,$要使两溶液均达饱和,则加入$Na_2SO_4$的质量大于NaCl的质量
答案:
D 解析:由图可知,甲的溶解度先随温度的升高而增大,后随温度的升高而减小,结合溶解度表可知,甲为Na₂SO₄,A错误;T₁℃时,甲、乙的溶解度均为36.0g,根据20℃时,NaCl的溶解度为35.9g,30℃时为36.3g,可确定T₁℃应介于20~30℃之间,B错误;将甲、乙的饱和溶液分别从T₃℃降温到T₂℃,甲的溶解度随温度的降低而增大,溶液变为不饱和溶液,但是溶液中溶质和溶剂的质量都不变,所以溶质质量分数不变,乙的溶解度随温度的降低而减小,溶液中有固体析出,溶质质量减小,溶剂质量不变,所以溶质质量分数变小,C错误;T₁℃时,NaCl和Na₂SO₄的溶解度相等,则等质量的NaCl、Na₂SO₄饱和溶液中溶剂、溶质的质量均相等,升温到T₃℃,T₃℃时Na₂SO₄的溶解度大于NaCl的溶解度,要使两种溶液均达到饱和,则加入的Na₂SO₄的质量应大于加入的NaCl的质量,D正确。
20.某同学从定量角度研究双氧水制取氧气的过程,在原实验基础上增加了称量操作,具体做法是取10%的双氧水和少量的二氧化锰放入气体发生装置中,并对反应前后混合物的质量进行称量。若反应前称得混合物的质量为34.3 g,反应后(双氧水分解完全且氧气全部逸出)称得混合物的质量为32.7 g。下列说法不正确的是(
A.二氧化锰的质量为0.3 g
B.得到氧气的质量为1.6 g
C.所取双氧水中过氧化氢的质量为3.4 g
D.反应后容器中水的质量为1.8 g
D
)A.二氧化锰的质量为0.3 g
B.得到氧气的质量为1.6 g
C.所取双氧水中过氧化氢的质量为3.4 g
D.反应后容器中水的质量为1.8 g
答案:
D 解析:生成氧气的质量为34.3g - 32.7g = 1.6g,故B说法正确。设生成1.6g氧气需要过氧化氢的质量为x。2H₂O₂$\stackrel{MnO₂}{=\!=\!=}$2H₂O + O₂↑ 68 32 x 1.6g 68/32 = x/1.6g x = 3.4g 所取双氧水的质量为3.4g/10% = 34g,二氧化锰的质量为34.3g - 34g = 0.3g,故A、C说法正确。反应后容器中水的质量为32.7g - 0.3g = 32.4g,故D说法错误。
21.(3分)在水中加入硫酸形成溶液,导电性明显增强,原因是
硫酸在水中溶解时能生成自由移动的H⁺和SO₄²⁻
;而在水中加入酒精形成溶液后却很难导电,原因是酒精溶于水后以分子的形式存在,不能形成自由移动的离子
。有下列物质:①氢氧化钠溶液、②干燥的氯化钠晶体、③稀盐酸、④蔗糖溶液、⑤液态氯化氢,其中含有自由移动的离子的是①③
(填序号)。
答案:
硫酸在水中溶解时能生成自由移动的H⁺和SO₄²⁻ 酒精溶于水后以分子的形式存在,不能形成自由移动的离子 ①③
22.(5分)(2024·南京雨花台模拟)溶液与人类的生产、生活息息相关。
(1)把少量下列物质分别放入水中,充分搅拌,可以得到溶液的是
A. 面粉 B. 氯化钠 C. 汽油 D. 蔗糖
(2)通常情况下,医用酒精中的溶剂是
(3)20℃时,取甲、乙、丙三种不含结晶水的固体物质各20 g,分别加入三个各盛有50 g水的烧杯中,充分溶解,溶解情况如表所示。
|物质|甲|乙|丙|

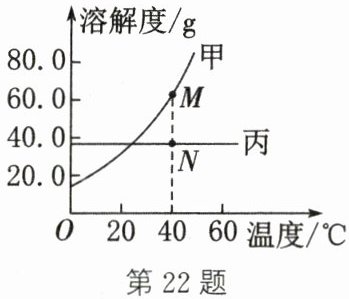
|未溶解固体的质量/g|4.2|0|2|
①所得丙溶液的质量是
②所得的甲、乙、丙溶液中溶质质量分数最大的是
③甲和丙的溶解度曲线如图,将图中M点所示甲饱和溶液和N点所示丙饱和溶液分别恒温蒸发50 g水,析出晶体质量大小关系是
A. 前者大于后者 B. 前者小于后者 C. 前者等于后者 D. 无法确定
(1)把少量下列物质分别放入水中,充分搅拌,可以得到溶液的是
BD
(填字母)。A. 面粉 B. 氯化钠 C. 汽油 D. 蔗糖
(2)通常情况下,医用酒精中的溶剂是
水
。(3)20℃时,取甲、乙、丙三种不含结晶水的固体物质各20 g,分别加入三个各盛有50 g水的烧杯中,充分溶解,溶解情况如表所示。
|物质|甲|乙|丙|


|未溶解固体的质量/g|4.2|0|2|
①所得丙溶液的质量是
68 g
。②所得的甲、乙、丙溶液中溶质质量分数最大的是
乙
。③甲和丙的溶解度曲线如图,将图中M点所示甲饱和溶液和N点所示丙饱和溶液分别恒温蒸发50 g水,析出晶体质量大小关系是
A
(填字母)。A. 前者大于后者 B. 前者小于后者 C. 前者等于后者 D. 无法确定
答案:
(1)BD (2)水 (3)① 68 g ② 乙 ③ A 解析:(3)① 该温度下,将20g丙溶于50g水中,2g丙未溶解,所得丙溶液的质量是50g + 20g - 2g = 68g。② 该温度下,取甲、乙、丙三种不含结晶水的固体物质各20g,分别加入三个各盛有50g水的烧杯中,充分溶解,未溶解固体的质量:甲>丙>乙,所得甲、乙、丙溶液中溶剂质量相同,溶质质量:乙>丙>甲,则溶质质量分数最大的是乙。③ 将图中M点所示甲饱和溶液和N点所示丙饱和溶液分别恒温蒸发50g水,该温度下,溶解度:甲>丙,饱和溶液中,溶解度越大,蒸发相同质量的水,析出晶体的质量越大,故析出晶体的质量:前者大于后者。
查看更多完整答案,请扫码查看


