第117页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
- 第131页
- 第132页
- 第133页
- 第134页
- 第135页
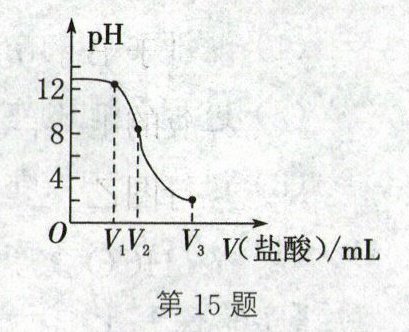
15. (2023·南通)已知常温下$Ca(OH)_2$的溶解度为0.17g。向一定量的饱和$Ca(OH)_2$溶液中滴加盐酸,溶液pH随V(盐酸)变化的曲线如图所示。为检测某生石灰样品中钙元素的含量,实验步骤如下:步骤1:取0.60g样品于锥形瓶中,向其中加入200mL蒸馏水(密度为$1g·mL⁻^1),$盖上表面皿充分振荡;步骤2:向冷却后的锥形瓶中滴入几滴酚酞,再逐滴加入盐酸至反应完全。反应完全时锥形瓶内溶液红色恰好褪去。经换算,消耗m(HCl)= 0.73g。下列说法正确的是(
A.步骤1中充分振荡后得到澄清透明的溶液
B.步骤2中红色恰好褪去时,消耗$V_2mL$盐酸
C.步骤2中发生反应的化学方程式为$2HCl+CaO= CaCl_2+H_2O$
D.该样品中钙元素的质量分数约为66.67%
D
)
A.步骤1中充分振荡后得到澄清透明的溶液
B.步骤2中红色恰好褪去时,消耗$V_2mL$盐酸
C.步骤2中发生反应的化学方程式为$2HCl+CaO= CaCl_2+H_2O$
D.该样品中钙元素的质量分数约为66.67%
答案:
D 解析:因为常温下氢氧化钙的溶解度为$0.17\,g$,$200\,mL$蒸馏水即$200\,g$蒸馏水中只能溶解$0.34\,g$氢氧化钙,$0.60\,g$样品与水反应生成的氢氧化钙不会全部溶解,步骤1中充分振荡后,溶液应该是浑浊的,A错误;恰好完全反应时,${pH}=7$,由图分析,消耗的盐酸的体积应该在$V_{2}\,mL$到$V_{3}\,mL$之间,B错误;步骤2中发生的反应是盐酸和氢氧化钙反应,化学方程式为${2HCl + Ca(OH)2=CaCl2 + 2H2O}$,C错误;根据题意可知加入的盐酸与生成的氢氧化钙反应,它们之间反应的关系式为$2{HCl}~{Ca(OH)2}~{Ca}$,所以消耗的氯化氢与钙元素的关系式为$2{HCl}~{Ca}$,与$0.73\,g$氯化氢反应的物质中钙元素的质量为$0.40\,g$,即原样品中钙元素的质量为$0.40\,g$,则原样品中钙元素的质量分数为$\dfrac{0.40\,g}{0.60\,g}× 100\%\approx 66.67\%$,D正确。故本题选D。
16. (6分)(2025·镇江期末)选择下列适当的物质填空(填序号):
A. 氦气 B. 活性炭 C. 青铜 D. 洗洁精 E. 氮气 F. 氯化钠 G. 干冰 H. 石灰石
(1)用于人工降雨的是
(2)用于探空气球的是
(3)厨房中作调味品的是
(4)生活中作乳化剂的是
(5)人类使用最早的合金是
(6)高炉炼铁用于造渣的矿石是
A. 氦气 B. 活性炭 C. 青铜 D. 洗洁精 E. 氮气 F. 氯化钠 G. 干冰 H. 石灰石
(1)用于人工降雨的是
G
。(2)用于探空气球的是
A
。(3)厨房中作调味品的是
F
。(4)生活中作乳化剂的是
D
。(5)人类使用最早的合金是
C
。(6)高炉炼铁用于造渣的矿石是
H
。
答案:
(1)G (2)A (3)F (4)D (5)C (6)H
17. (6分)(2025·南京玄武期末)水和溶液在生活中具有广泛的用途。
(1)生理盐水是医疗上常用的一种溶液,一瓶合格的生理盐水密封放置一段时间后,不会出现浑浊的原因是
(2)不同的物质在同一溶剂中的溶解性是不同的。请利用高锰酸钾、碘和水设计实验验证:
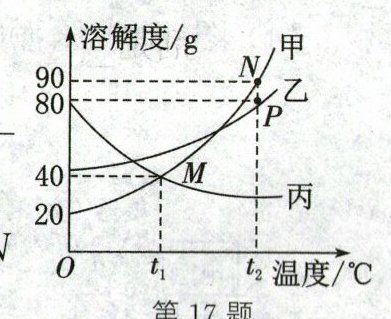
(3)甲、乙、丙三种固体物质的溶解度曲线如图所示,请回答下列问题。
①M点的意义是
②在不改变溶液中溶质质量的情况下,欲将P点对应的甲溶液变为N点对应的甲溶液,可采用的方法是
$③t_2℃$时,在50g水中加入20g甲、乙、丙三种固体物质中的某种物质,充分搅拌后,固体不能全部溶解,则该物质是
$④t_2℃$时,取甲、乙、丙三种物质的饱和溶液各100g,分别降温到$t_1℃,$所得溶液的质量由大到小的顺序为
(1)生理盐水是医疗上常用的一种溶液,一瓶合格的生理盐水密封放置一段时间后,不会出现浑浊的原因是
溶液具有稳定性
。(2)不同的物质在同一溶剂中的溶解性是不同的。请利用高锰酸钾、碘和水设计实验验证:
取两支试管,分别加入等量的水,向其中一支试管加入一小粒的高锰酸钾,振荡,观察到高锰酸钾溶于水,溶液呈紫红色;向另一支试管加入一小粒的碘,振荡,观察到碘几乎不溶于水(合理答案均可)
(填实验操作及现象),得出结论:不同的物质在同一溶剂中的溶解性是不同的。(3)甲、乙、丙三种固体物质的溶解度曲线如图所示,请回答下列问题。
①M点的意义是
$t_{1}{\hspace{0pt}}^{\circ }\mathrm{C} $时,甲和丙的溶解度相等,均为$40\,g$
。②在不改变溶液中溶质质量的情况下,欲将P点对应的甲溶液变为N点对应的甲溶液,可采用的方法是
恒温蒸发溶剂至恰好饱和
。$③t_2℃$时,在50g水中加入20g甲、乙、丙三种固体物质中的某种物质,充分搅拌后,固体不能全部溶解,则该物质是
丙
。$④t_2℃$时,取甲、乙、丙三种物质的饱和溶液各100g,分别降温到$t_1℃,$所得溶液的质量由大到小的顺序为
丙>乙>甲
。
答案:
(1)溶液具有稳定性 (2)取两支试管,分别加入等量的水,向其中一支试管加入一小粒的高锰酸钾,振荡,观察到高锰酸钾溶于水,溶液呈紫红色;向另一支试管加入一小粒的碘,振荡,观察到碘几乎不溶于水(合理答案均可) (3)①$t_{1}{\hspace{0pt}}^{\circ }\mathrm{C} $时,甲和丙的溶解度相等,均为$40\,g$ ②恒温蒸发溶剂至恰好饱和 ③丙 ④丙>乙>甲
18. (5分)(2025·南京玄武期末)金属材料在生产、生活中有着重要的作用。
Ⅰ. 金属的冶炼。
(1)工业冶炼铝的原理为电解熔融的$Al_2O_3,$生成铝和一种气体。该反应的化学方程式为______
(2)生活中铝制品有很好的抗腐蚀性能,其主要原因是______
Ⅱ. 金属的回收。废旧手机的电路板中主要含有铜,还含有少量铝、铁、金。为回收其中的铜、金,设计了如图所示流程。已知:①金在该流程中均不发生反应;②Cu可以与过氧化氢和稀硫酸的混合溶液发生反应,反应的化学方程式为$Cu+H_2O_2+H_2SO_4= CuSO_4+2H_2O。$
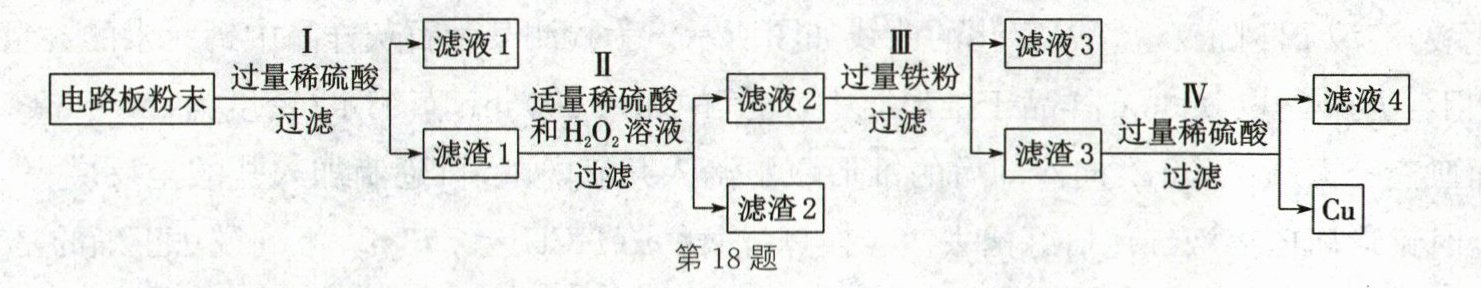
(1)滤液1中的溶质除了$FeSO_4$外还有______
(2)过程Ⅱ中的主要实验现象是______
(3)过程Ⅲ中发生反应的化学方程式是______
Ⅰ. 金属的冶炼。
(1)工业冶炼铝的原理为电解熔融的$Al_2O_3,$生成铝和一种气体。该反应的化学方程式为______
$2Al₂O₃\xlongequal{通电}4Al + 3O₂↑$
。(2)生活中铝制品有很好的抗腐蚀性能,其主要原因是______
铝在常温下会与空气中的氧气反应,在其表面生成一层致密的氧化铝薄膜,从而阻止铝被进一步氧化
。Ⅱ. 金属的回收。废旧手机的电路板中主要含有铜,还含有少量铝、铁、金。为回收其中的铜、金,设计了如图所示流程。已知:①金在该流程中均不发生反应;②Cu可以与过氧化氢和稀硫酸的混合溶液发生反应,反应的化学方程式为$Cu+H_2O_2+H_2SO_4= CuSO_4+2H_2O。$

(1)滤液1中的溶质除了$FeSO_4$外还有______
Al₂(SO₄)₃、H₂SO₄
(填化学式)。(2)过程Ⅱ中的主要实验现象是______
固体部分溶解,溶液由无色变为蓝色
。(3)过程Ⅲ中发生反应的化学方程式是______
Fe + CuSO₄=FeSO₄ + Cu
。
答案:
Ⅰ.(1)${2Al2O3\xlongequal{通电}4Al + 3O2\uparrow }$ (2)铝在常温下会与空气中的氧气反应,在其表面生成一层致密的氧化铝薄膜,从而阻止铝被进一步氧化 Ⅱ.(1)${Al2(SO4)3}$、${H2SO4}$ (2)固体部分溶解,溶液由无色变为蓝色 (3)${Fe + CuSO4=FeSO4 + Cu}$
查看更多完整答案,请扫码查看


