第119页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
- 第131页
- 第132页
- 第133页
- 第134页
- 第135页
20. (6分)(2023·金昌)A、B、C均含同一种元素,A为单质,B有毒,D为红棕色粉末,M是一种常见的酸,I俗称生石灰。它们之间存在如图转化关系,根据以上信息回答下列问题。
(1)写出物质F的化学式:
(2)反应②属于
(3)写出反应①的化学方程式:
(4)用简洁的语言描述E→G反应的现象:
(5)写出物质J在生活、生产中一种常见的用途:
(1)写出物质F的化学式:
CaCO3
,H溶液中金属阳离子的符号为Fe3+
。(2)反应②属于
复分解反应
(填基本反应类型)。(3)写出反应①的化学方程式:
$3CO + Fe2O3\xlongequal{高温}2Fe + 3CO2$
。(4)用简洁的语言描述E→G反应的现象:
固体逐渐溶解,有气泡产生,溶液由无色逐渐变为浅绿色
。(5)写出物质J在生活、生产中一种常见的用途:
配制农药波尔多液(或改良酸性土壤等合理答案均可)
。
答案:
(1)${CaCO3}$ ${Fe^{3+}}$ (2)复分解反应 (3)${3CO + Fe2O3\xlongequal{高温}2Fe + 3CO2}$ (4)固体逐渐溶解,有气泡产生,溶液由无色逐渐变为浅绿色 (5)配制农药波尔多液(或改良酸性土壤等合理答案均可)
21. (5分)(2024·湖北)某工厂在粗盐的提纯过程中产生了大量的"盐泥"[主要成分为$Mg(OH)_2、$$BaSO_4$和NaCl]。利用"盐泥"制备硫酸镁晶体的工艺流程如图所示。已知:两种物质在不同温度时的溶解度如表。
|温度/℃|0|20|40|60|80|
|溶解度/g|NaCl|35.7|35.9|36.6|37.3|38.4|
||$MgSO_4$|22.0|33.7|44.5|54.6|55.8|
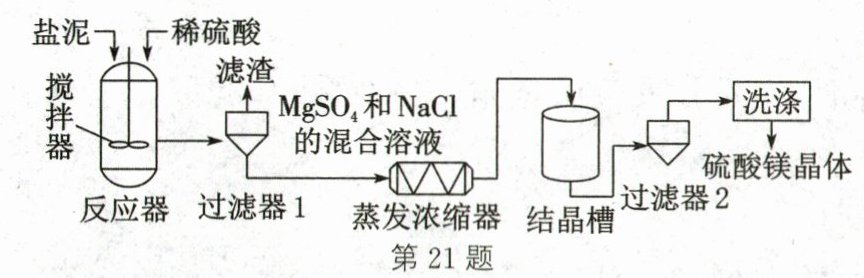
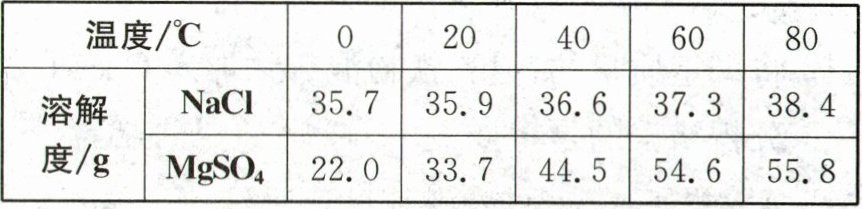
(1)20℃时,NaCl的溶解度为______g。
(2)"反应器"中发生反应的化学方程式为______。
(3)"过滤器1"产生的"滤渣"为______。
(4)"结晶槽"中获得硫酸镁晶体的方法是______结晶。
(5)从"结晶槽"中获得的硫酸镁晶体表面附着有杂质,需用试剂洗去。为避免晶体损失,最适宜的洗涤试剂是______。
(1)
(2)
(3)
(4)
(5)
|温度/℃|0|20|40|60|80|
|溶解度/g|NaCl|35.7|35.9|36.6|37.3|38.4|
||$MgSO_4$|22.0|33.7|44.5|54.6|55.8|


(1)20℃时,NaCl的溶解度为______g。
(2)"反应器"中发生反应的化学方程式为______。
(3)"过滤器1"产生的"滤渣"为______。
(4)"结晶槽"中获得硫酸镁晶体的方法是______结晶。
(5)从"结晶槽"中获得的硫酸镁晶体表面附着有杂质,需用试剂洗去。为避免晶体损失,最适宜的洗涤试剂是______。
(1)
35.9
(2)
${Mg(OH)2 + H2SO4=MgSO4 + 2H2O}$
(3)
${BaSO4}$(或硫酸钡)
(4)
冷却(或降温)
(5)
饱和硫酸镁溶液(或饱和${MgSO4}$溶液)
答案:
(1)35.9 (2)${Mg(OH)2 + H2SO4=MgSO4 + 2H2O}$ (3)${BaSO4}$(或硫酸钡) (4)冷却(或降温) (5)饱和硫酸镁溶液(或饱和${MgSO4}$溶液)
22. (7分)(2024·镇江句容期末)铜是一种应用广泛的金属。
探究一:铜的应用与防护。
(1)铜作导线是利用了铜具有良好的
(2)铜制品长期露置在空气中会生成"铜绿",反应的化学方程式为
探究二:实验室制备铜及产物分析。
某小组取16.0g CuO粉末,按如图装置进行实验。加热一段时间,固体全部变为红色后停止加热,冷却后测得剩余固体质量为13.6g。已知:碱石灰能吸收水蒸气和二氧化碳;Cu和$Cu_2O$均为红色固体。
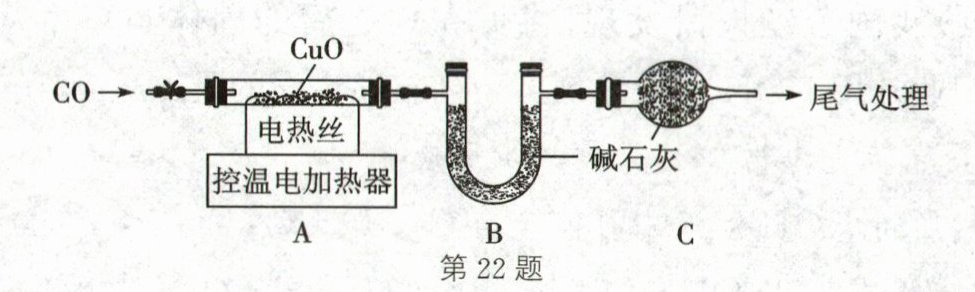
【分析】实验时,应先
【提问】生成的红色固体成分是什么?
【猜想】猜想1:Cu;猜想$2:Cu_2O;$猜想3:Cu与$Cu_2O$的混合物。
【讨论】若猜想1正确,则得到剩余固体的质量应该为
【结论】猜想3正确。
(1)通过计算得到:剩余固体中Cu和$Cu_2O$的质量分别为
(2)利用所得数据,写出该实验中A装置中发生反应的化学方程式:
探究一:铜的应用与防护。
(1)铜作导线是利用了铜具有良好的
导电性和延展性
。(2)铜制品长期露置在空气中会生成"铜绿",反应的化学方程式为
${2Cu + O2 + CO2 + H2O=Cu2(OH)2CO3}$
。探究二:实验室制备铜及产物分析。
某小组取16.0g CuO粉末,按如图装置进行实验。加热一段时间,固体全部变为红色后停止加热,冷却后测得剩余固体质量为13.6g。已知:碱石灰能吸收水蒸气和二氧化碳;Cu和$Cu_2O$均为红色固体。

【分析】实验时,应先
通一段时间的CO
(填"加热样品"或"通一段时间的CO")。A装置减少的质量小于
(填"大于""小于"或"等于")C装置增加的质量。【提问】生成的红色固体成分是什么?
【猜想】猜想1:Cu;猜想$2:Cu_2O;$猜想3:Cu与$Cu_2O$的混合物。
【讨论】若猜想1正确,则得到剩余固体的质量应该为
12.8
g,经分析、计算后得到猜想1、2均错误。【结论】猜想3正确。
(1)通过计算得到:剩余固体中Cu和$Cu_2O$的质量分别为
$6.4\,g$、$7.2\,g$
。(2)利用所得数据,写出该实验中A装置中发生反应的化学方程式:
${3CO + 4CuO\xlongequal{\Delta }2Cu + Cu2O + 3CO2}$
(提示:要考虑反应生成的Cu与$Cu_2O$的质量关系)。
答案:
探究一:(1)导电性和延展性 (2)${2Cu + O2 + CO2 + H2O=Cu2(OH)2CO3}$ 探究二:【分析】通一段时间的CO 小于 【讨论】12.8 【结论】(1)$6.4\,g$、$7.2\,g$ (2)${3CO + 4CuO\xlongequal{\Delta }2Cu + Cu2O + 3CO2}$
查看更多完整答案,请扫码查看


