第77页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
- 第131页
- 第132页
- 第133页
- 第134页
- 第135页
26.(4分$)t_1℃$时,将a、b两种固体各25 g,分别加入盛有100 g水的烧杯中,充分搅拌后现象如图甲,升温到$t_2℃$时,现象如图乙。a、b两种固体在水中的溶解度曲线如图丙,请回答下列问题:
(1)图丙中,曲线______
$(2)t_2℃$时,烧杯中a的溶液属于______
(3)图乙中,a物质所形成溶液的溶质质量分数是______
(4)将图乙两烧杯中所有物质倒入一个大烧杯中(假设a、b不反应),则b物质未溶解部分的变化情况是______
(1)图丙中,曲线______
M
(填“M”或“N”)表示的是a物质的溶解度曲线。$(2)t_2℃$时,烧杯中a的溶液属于______
不饱和
(填“饱和”或“不饱和”)溶液。(3)图乙中,a物质所形成溶液的溶质质量分数是______
20%
。(4)将图乙两烧杯中所有物质倒入一个大烧杯中(假设a、b不反应),则b物质未溶解部分的变化情况是______
减少
(填“增多”“减少”或“不变”)。
答案:
(1)M (2)不饱和 (3)20% (4)减少 解析:(1)t₁℃时,将a、b两种固体各25g,分别加入盛有100g水的烧杯中,充分搅拌后现象如题图甲,温度升高到t₂℃时,a完全溶解,说明a的溶解度随温度的升高而增大,根据溶解度曲线图可知M表示的是a物质的溶解度曲线。(2)t₂℃时,a的溶解度是60g,100g水中最多能溶60g a,而烧杯中a的质量为25g,故此时a的溶液属于不饱和溶液。(3)题图乙中,a物质所形成溶液的溶质质量分数是25g/(100g + 25g)×100% = 20%。(4)由于混合后溶剂质量增大,因此原来未溶解的b可以继续溶解。
27.(8分)如图为碳酸钠和碳酸氢钠两种物质的溶解度曲线,请回答下列问题。
(1)从曲线可以判断$,Na_2CO_3$和$NaHCO_3$两种物质的溶解性属于“易溶”的是
(2)将40℃时等质量的$Na_2CO_3$和$NaHCO_3$的饱和溶液同时降温到10℃,析出晶体较少的是
(3)小英同学说,60℃时她配制了一瓶溶质质量分数为16.4%的$NaHCO_3$饱和溶液,小英同学的说法是否正确?
(4)将30℃时等质量的$Na_2CO_3$和$NaHCO_3$的饱和溶液分别恒温蒸发10 g水,析出晶体较多的是
(1)从曲线可以判断$,Na_2CO_3$和$NaHCO_3$两种物质的溶解性属于“易溶”的是
$Na_2CO_3$
(填化学式)。请描述$Na_2CO_3$的溶解度受温度影响的变化情况:当温度低于40℃时,随着温度的升高,$Na_2CO_3$的溶解度增大;当温度高于40℃时,随着温度的升高,$Na_2CO_3$的溶解度减小
。(2)将40℃时等质量的$Na_2CO_3$和$NaHCO_3$的饱和溶液同时降温到10℃,析出晶体较少的是
$NaHCO_3$
(填化学式)溶液。要使B点的$Na_2CO_3$溶液(含100 g水)变为A点的溶液,可以再增加溶质10
g或恒温蒸发水20
g。(3)小英同学说,60℃时她配制了一瓶溶质质量分数为16.4%的$NaHCO_3$饱和溶液,小英同学的说法是否正确?
否
(填“是”或“否”)。(4)将30℃时等质量的$Na_2CO_3$和$NaHCO_3$的饱和溶液分别恒温蒸发10 g水,析出晶体较多的是
$Na_2CO_3$
(填化学式)溶液。0~40℃内要提纯含有少量碳酸氢钠的碳酸钠,可以采用的结晶方法是降温结晶
(填“蒸发结晶”或“降温结晶”)。
答案:
(1)Na₂CO₃ 当温度低于40℃时,随着温度的升高,Na₂CO₃的溶解度增大;当温度高于40℃时,随着温度的升高,Na₂CO₃的溶解度减小 (2)NaHCO₃ 10 20 (3)否 (4)Na₂CO₃ 降温结晶 解析:(1)20℃时,碳酸钠的溶解度大于10g,碳酸氢钠的溶解度小于10g,所以Na₂CO₃和NaHCO₃两种物质的溶解性属于“易溶”的是碳酸钠。当温度低于40℃时,随着温度的升高,Na₂CO₃的溶解度增大;当温度高于40℃时,随着温度的升高,Na₂CO₃的溶解度减小。(2)40℃降温到10℃时,碳酸钠和碳酸氢钠的溶解度都减小,溶液中都有晶体析出,但碳酸氢钠的溶解度受温度的影响小,故析出晶体较少的是碳酸氢钠溶液。要使B点的Na₂CO₃溶液(含100g水)变为A点的溶液,可以再增加溶质50g - 40g = 10g,也可以设恒温蒸发水的质量为x,则50g/(100g + 50g) = 40g/(100g - x),解得x = 20g。(3)60℃时碳酸氢钠的溶解度为16.4g,此时碳酸氢钠饱和溶液的溶质质量分数为16.4g/(100g + 16.4g)×100%≈14.1%<16.4%,故小英同学的说法错误。(4)将30℃时等质量的Na₂CO₃和NaHCO₃的饱和溶液分别恒温蒸发10g水,因为30℃时碳酸钠的溶解度更大,所以析出晶体较多的是碳酸钠溶液。0~40℃内,碳酸钠的溶解度受温度的影响较大,碳酸氢钠的溶解度受温度的影响较小,要提纯含有少量碳酸氢钠的碳酸钠,应采用降温结晶的方法。
28.现需要配制80 g溶质质量分数为16%的氯化钠溶液,请按要求回答下列问题:
(1)如图甲,该实验正确的操作顺序是______(填字母)。
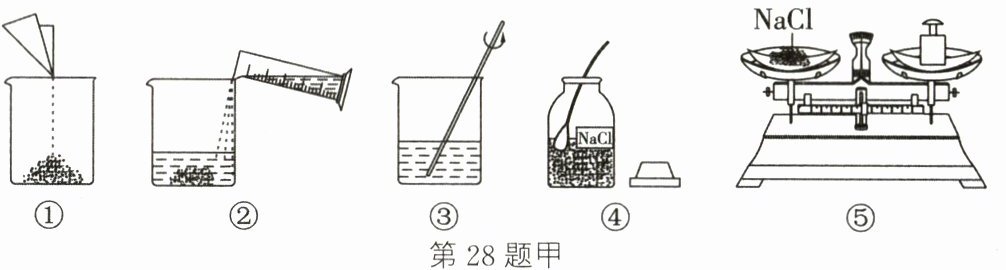
A. ①②③④⑤ B. ④⑤①②③ C. ④⑤②①③ D. ④①⑤②③
(2)配制80 g溶质质量分数为16%的氯化钠溶液需要氯化钠______g,量取所需的水最好选用______(填字母)规格的量筒(已知ρ_{水}= 1.0 g·mL^{-1})。
A. 100 mL B. 50 mL C. 10 mL
(3)用托盘天平称量所需的氯化钠时,发现天平指针偏向右盘,应______(填字母)。
A. 增加适量氯化钠固体 B. 减少适量氯化钠固体 C. 调节平衡螺母 D. 减少砝码
(4)溶解时,将水倒入盛有氯化钠的烧杯中,用玻璃棒进行搅拌,其目的是______。
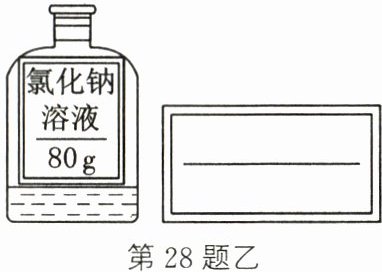
(5)将配制好的溶液装瓶并贴上标签。小明同学贴的标签有不妥之处,如图乙所示,请在空白标签上填写正确内容。
(6)若配制所得的氯化钠溶液中氯化钠的质量分数偏小,可能的原因是______(填字母)。
A. 用量筒量取水时俯视读数 B. 往烧杯中倾倒量取好的蒸馏水时,有少量水溅出 C. 所用氯化钠固体未充分干燥 D. 转移已称好的氯化钠固体时,部分撒落在烧杯外
(1)如图甲,该实验正确的操作顺序是______(填字母)。

A. ①②③④⑤ B. ④⑤①②③ C. ④⑤②①③ D. ④①⑤②③
(2)配制80 g溶质质量分数为16%的氯化钠溶液需要氯化钠______g,量取所需的水最好选用______(填字母)规格的量筒(已知ρ_{水}= 1.0 g·mL^{-1})。
A. 100 mL B. 50 mL C. 10 mL
(3)用托盘天平称量所需的氯化钠时,发现天平指针偏向右盘,应______(填字母)。
A. 增加适量氯化钠固体 B. 减少适量氯化钠固体 C. 调节平衡螺母 D. 减少砝码
(4)溶解时,将水倒入盛有氯化钠的烧杯中,用玻璃棒进行搅拌,其目的是______。
(5)将配制好的溶液装瓶并贴上标签。小明同学贴的标签有不妥之处,如图乙所示,请在空白标签上填写正确内容。

(6)若配制所得的氯化钠溶液中氯化钠的质量分数偏小,可能的原因是______(填字母)。
A. 用量筒量取水时俯视读数 B. 往烧杯中倾倒量取好的蒸馏水时,有少量水溅出 C. 所用氯化钠固体未充分干燥 D. 转移已称好的氯化钠固体时,部分撒落在烧杯外
答案:
(1)B (2)12.8 A (3)A (4)加快溶解 (5)如图所示 (6)CD 解析:(2)配制80g溶质质量分数为16%的氯化钠溶液需要氯化钠的质量为80g×16% = 12.8g,所需溶剂的质量为80g - 12.8g = 67.2g,即67.2mL,所以量取所需的水最好选用100mL规格的量筒,故选A。(3)用托盘天平称量所需的氯化钠时,发现天平指针偏向右盘,说明砝码与游码的总质量大于氯化钠的质量,应增加适量氯化钠固体,故选A。(5)标签上需要注明试剂名称和溶液的溶质质量分数。(6)配制所得的氯化钠溶液中氯化钠的质量分数偏小,可能的原因是溶质质量偏小或溶剂质量偏大。用量筒量取水时俯视读数,会造成实际量取的水的体积偏小,则使溶质质量分数偏大,故A错误;,往烧杯中倾倒量取好的蒸馏水时,少量水溅出,会造成实际用来配制溶液的水的体积偏小,则使溶质质量分数偏大,故B错误;所用氯化钠固体未充分干燥,溶质质量减小了,则使溶质质量分数偏小,故C正确;转移已称好的氯化钠固体时,部分撒落在烧杯外,溶质质量减小了,则使溶质质量分数偏小,故D正确。
解析:(2)配制80g溶质质量分数为16%的氯化钠溶液需要氯化钠的质量为80g×16% = 12.8g,所需溶剂的质量为80g - 12.8g = 67.2g,即67.2mL,所以量取所需的水最好选用100mL规格的量筒,故选A。(3)用托盘天平称量所需的氯化钠时,发现天平指针偏向右盘,说明砝码与游码的总质量大于氯化钠的质量,应增加适量氯化钠固体,故选A。(5)标签上需要注明试剂名称和溶液的溶质质量分数。(6)配制所得的氯化钠溶液中氯化钠的质量分数偏小,可能的原因是溶质质量偏小或溶剂质量偏大。用量筒量取水时俯视读数,会造成实际量取的水的体积偏小,则使溶质质量分数偏大,故A错误;,往烧杯中倾倒量取好的蒸馏水时,少量水溅出,会造成实际用来配制溶液的水的体积偏小,则使溶质质量分数偏大,故B错误;所用氯化钠固体未充分干燥,溶质质量减小了,则使溶质质量分数偏小,故C正确;转移已称好的氯化钠固体时,部分撒落在烧杯外,溶质质量减小了,则使溶质质量分数偏小,故D正确。
(1)B (2)12.8 A (3)A (4)加快溶解 (5)如图所示 (6)CD
 解析:(2)配制80g溶质质量分数为16%的氯化钠溶液需要氯化钠的质量为80g×16% = 12.8g,所需溶剂的质量为80g - 12.8g = 67.2g,即67.2mL,所以量取所需的水最好选用100mL规格的量筒,故选A。(3)用托盘天平称量所需的氯化钠时,发现天平指针偏向右盘,说明砝码与游码的总质量大于氯化钠的质量,应增加适量氯化钠固体,故选A。(5)标签上需要注明试剂名称和溶液的溶质质量分数。(6)配制所得的氯化钠溶液中氯化钠的质量分数偏小,可能的原因是溶质质量偏小或溶剂质量偏大。用量筒量取水时俯视读数,会造成实际量取的水的体积偏小,则使溶质质量分数偏大,故A错误;,往烧杯中倾倒量取好的蒸馏水时,少量水溅出,会造成实际用来配制溶液的水的体积偏小,则使溶质质量分数偏大,故B错误;所用氯化钠固体未充分干燥,溶质质量减小了,则使溶质质量分数偏小,故C正确;转移已称好的氯化钠固体时,部分撒落在烧杯外,溶质质量减小了,则使溶质质量分数偏小,故D正确。
解析:(2)配制80g溶质质量分数为16%的氯化钠溶液需要氯化钠的质量为80g×16% = 12.8g,所需溶剂的质量为80g - 12.8g = 67.2g,即67.2mL,所以量取所需的水最好选用100mL规格的量筒,故选A。(3)用托盘天平称量所需的氯化钠时,发现天平指针偏向右盘,说明砝码与游码的总质量大于氯化钠的质量,应增加适量氯化钠固体,故选A。(5)标签上需要注明试剂名称和溶液的溶质质量分数。(6)配制所得的氯化钠溶液中氯化钠的质量分数偏小,可能的原因是溶质质量偏小或溶剂质量偏大。用量筒量取水时俯视读数,会造成实际量取的水的体积偏小,则使溶质质量分数偏大,故A错误;,往烧杯中倾倒量取好的蒸馏水时,少量水溅出,会造成实际用来配制溶液的水的体积偏小,则使溶质质量分数偏大,故B错误;所用氯化钠固体未充分干燥,溶质质量减小了,则使溶质质量分数偏小,故C正确;转移已称好的氯化钠固体时,部分撒落在烧杯外,溶质质量减小了,则使溶质质量分数偏小,故D正确。 查看更多完整答案,请扫码查看


