2025年学习与评价江苏凤凰教育出版社高中化学必修第二册苏教版河北专版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年学习与评价江苏凤凰教育出版社高中化学必修第二册苏教版河北专版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第34页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
- 第131页
- 第132页
- 第133页
- 第134页
- 第135页
- 第136页
22.(10分)经研究知Cu²+对H2O2分解也具有催化作用,为比较Fe³+和Cu²+对H2O2分解的催化效果,某研究小组的同学分别设计了如下图甲、乙所示的实验。回答相关问题:
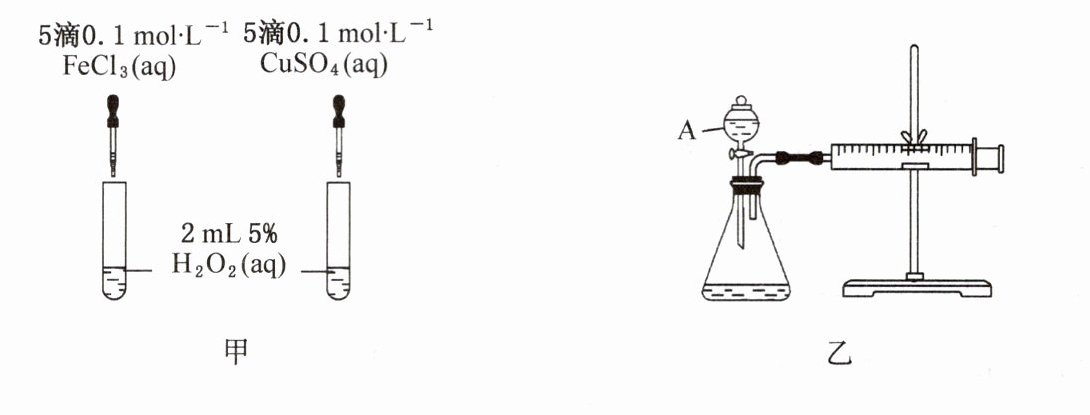
(1)定性分析:如图甲可通过观察__________________________,定性比较得出结论。有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是______________________________,写出H2O2在二氧化锰催化作用下发生反应的化学方程式:______________________________。
(2)定量分析:如图乙所示,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略。图中仪器A的名称为________,实验中需要测量的数据是____________________________。

(1)定性分析:如图甲可通过观察__________________________,定性比较得出结论。有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是______________________________,写出H2O2在二氧化锰催化作用下发生反应的化学方程式:______________________________。
(2)定量分析:如图乙所示,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略。图中仪器A的名称为________,实验中需要测量的数据是____________________________。
答案:
(1)反应产生气泡的快慢 控制阴离子相同,排除阴离子的干扰 2H₂O₂$\stackrel{MnO₂}{=\!=\!=}$2H₂O + O₂↑
(2)分液漏斗 收集40mL气体所需要的时间
(1)反应产生气泡的快慢 控制阴离子相同,排除阴离子的干扰 2H₂O₂$\stackrel{MnO₂}{=\!=\!=}$2H₂O + O₂↑
(2)分液漏斗 收集40mL气体所需要的时间
23.(10分)化学反应速率和限度与生产、生活密切相关。
(1)某学生为了探究锌与盐酸反应过程中的速率变化,在400mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
①哪一时间段反应速率最大?________(填“0~1"“1~2”“2~3"“3~4"或“4~5")min,原因是______________________________。
②在3~4min时间段内,以盐酸的浓度变化来表示的该反应速率为________________(假设溶液体积不变)。
(2)另一学生为控制反应速率防止反应过快难以测量氢气体积,他事先在盐酸中加入等体积的下列溶液以减慢反应速率,你认为不可行的是________(填字母)。
A.蒸馏水 B.KC1溶液 C.KNO溶液 D.CuSO4溶液
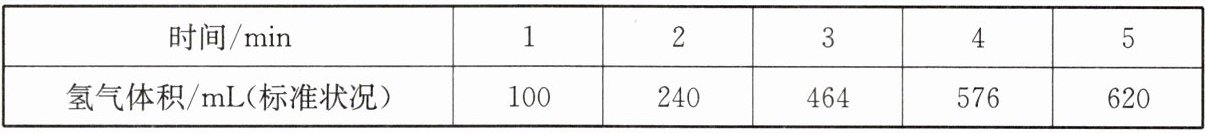
(1)某学生为了探究锌与盐酸反应过程中的速率变化,在400mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
①哪一时间段反应速率最大?________(填“0~1"“1~2”“2~3"“3~4"或“4~5")min,原因是______________________________。
②在3~4min时间段内,以盐酸的浓度变化来表示的该反应速率为________________(假设溶液体积不变)。
(2)另一学生为控制反应速率防止反应过快难以测量氢气体积,他事先在盐酸中加入等体积的下列溶液以减慢反应速率,你认为不可行的是________(填字母)。
A.蒸馏水 B.KC1溶液 C.KNO溶液 D.CuSO4溶液

答案:
(1)①2~3 该反应是放热反应,此时温度高且盐酸浓度较大,所以反应速率较快 ②0.025mol·L⁻¹·min⁻¹
(2)CD [解析]
(1)②在3~4min时间段内,n(H₂)=$\frac{0.112L}{22.4L·mol⁻¹}$ = 0.005mol,消耗盐酸的物质的量为0.01mol,故v(HCl)=$\frac{0.01mol}{0.4L×1min}$ = 0.025mol·L⁻¹·min⁻¹。
(2)加入蒸馏水及加入KCl溶液,H⁺的浓度减小,反应速率减小且不减少产生氢气的量,故A、B项正确;C项,加入KNO₃溶液,H⁺的浓度减小,因酸性溶液中的NO₃⁻具有强氧化性,与Zn反应无氢气生成,错误;D项,加入CuSO₄溶液,形成原电池,反应速率增大,且影响生成氢气的量,错误。
(1)①2~3 该反应是放热反应,此时温度高且盐酸浓度较大,所以反应速率较快 ②0.025mol·L⁻¹·min⁻¹
(2)CD [解析]
(1)②在3~4min时间段内,n(H₂)=$\frac{0.112L}{22.4L·mol⁻¹}$ = 0.005mol,消耗盐酸的物质的量为0.01mol,故v(HCl)=$\frac{0.01mol}{0.4L×1min}$ = 0.025mol·L⁻¹·min⁻¹。
(2)加入蒸馏水及加入KCl溶液,H⁺的浓度减小,反应速率减小且不减少产生氢气的量,故A、B项正确;C项,加入KNO₃溶液,H⁺的浓度减小,因酸性溶液中的NO₃⁻具有强氧化性,与Zn反应无氢气生成,错误;D项,加入CuSO₄溶液,形成原电池,反应速率增大,且影响生成氢气的量,错误。
24.(10分)将4molA气体和2molB气体在2L的容器中混合并在一定条件下发生如下反应:2A(g)+B(g)− 2C(g)。若经2s时测得C的浓度为0.6mol.L−¹,填写下列空白:
(1)用物质A表示反应的平均速率为____________________________。
(2)用物质B表示反应的平均速率为____________________________。
(3)2s时物质A的转化率为____________________________。
(1)用物质A表示反应的平均速率为____________________________。
(2)用物质B表示反应的平均速率为____________________________。
(3)2s时物质A的转化率为____________________________。
答案:
(1)0.3mol·L⁻¹·s⁻¹
(2)0.15mol·L⁻¹·s⁻¹
(3)30% [解析]
2A(g) + B(g) ⇌ 2C(g)
起始浓度 2mol·L⁻¹ 1mol·L⁻¹ 0
变化浓度 0.6mol·L⁻¹ 0.3mol·L⁻¹ 0.6mol·L⁻¹
2s时浓度 1.4mol·L⁻¹ 0.7mol·L⁻¹ 0.6mol·L⁻¹
(1)v(A)=$\frac{0.6mol·L⁻¹}{2s}$ = 0.3mol·L⁻¹·s⁻¹
(2)v(B)=$\frac{0.3mol·L⁻¹}{2s}$ = 0.15mol·L⁻¹·s⁻¹
(3)A的转化率为$\frac{0.6mol·L⁻¹}{2mol·L⁻¹}$×100% = 30%
(1)0.3mol·L⁻¹·s⁻¹
(2)0.15mol·L⁻¹·s⁻¹
(3)30% [解析]
2A(g) + B(g) ⇌ 2C(g)
起始浓度 2mol·L⁻¹ 1mol·L⁻¹ 0
变化浓度 0.6mol·L⁻¹ 0.3mol·L⁻¹ 0.6mol·L⁻¹
2s时浓度 1.4mol·L⁻¹ 0.7mol·L⁻¹ 0.6mol·L⁻¹
(1)v(A)=$\frac{0.6mol·L⁻¹}{2s}$ = 0.3mol·L⁻¹·s⁻¹
(2)v(B)=$\frac{0.3mol·L⁻¹}{2s}$ = 0.15mol·L⁻¹·s⁻¹
(3)A的转化率为$\frac{0.6mol·L⁻¹}{2mol·L⁻¹}$×100% = 30%
查看更多完整答案,请扫码查看


