2025年学习与评价江苏凤凰教育出版社高中化学必修第二册苏教版河北专版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年学习与评价江苏凤凰教育出版社高中化学必修第二册苏教版河北专版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第124页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
- 第131页
- 第132页
- 第133页
- 第134页
- 第135页
- 第136页
1. 相同物质的量的钠、镁、铝三种金属分别与足量的盐酸反应:
(1) 反应剧烈程度最大的是________。
(2) 完全反应后,产生氢气最多的是________。
(3) 相同条件下,三种金属产生氢气的体积比是________。
(1) 反应剧烈程度最大的是________。
(2) 完全反应后,产生氢气最多的是________。
(3) 相同条件下,三种金属产生氢气的体积比是________。
答案:
(1)钠
(2)铝
(3)1:2:3
(1)钠
(2)铝
(3)1:2:3
2. 冶炼金属一般有下列方法:①热分解法,②高温还原法,③活泼金属置换法,④电解法。四种方法在工业上均有应用。请对下表中的金属冶炼方法进行分析,从上述四种方法中选择相应的序号填入下表。


答案:
① ③ ② ③ ④
二、核心问题突破
问题一 热还原法冶炼金属的分类和优、缺点。
1. 分类

相关化学方程式:
H₂ + CuO$\stackrel{高温}{=\!=\!=}$Cu + H₂O
C + 2CuO$\stackrel{高温}{=\!=\!=}$2Cu + CO₂
4H₂ + Fe₃O₄$\stackrel{高温}{=\!=\!=}$3Fe + 4H₂O
Fe₂O₃ + 3CO$\stackrel{高温}{=\!=\!=}$2Fe + 3CO₂
2Al + Fe₂O₃$\stackrel{高温}{=\!=\!=}$2Fe + Al₂O₃
2. 优、缺点
用 H₂ 还原法冶炼金属,获得的金属纯度高,但成本也高;用 CO 和 C 还原法冶炼金属,获得的金属纯度低,冶炼成本也低;用铝热法可以冶炼熔点高、难冶炼的金属,成本较高。
问题一 热还原法冶炼金属的分类和优、缺点。
1. 分类

相关化学方程式:
H₂ + CuO$\stackrel{高温}{=\!=\!=}$Cu + H₂O
C + 2CuO$\stackrel{高温}{=\!=\!=}$2Cu + CO₂
4H₂ + Fe₃O₄$\stackrel{高温}{=\!=\!=}$3Fe + 4H₂O
Fe₂O₃ + 3CO$\stackrel{高温}{=\!=\!=}$2Fe + 3CO₂
2Al + Fe₂O₃$\stackrel{高温}{=\!=\!=}$2Fe + Al₂O₃
2. 优、缺点
用 H₂ 还原法冶炼金属,获得的金属纯度高,但成本也高;用 CO 和 C 还原法冶炼金属,获得的金属纯度低,冶炼成本也低;用铝热法可以冶炼熔点高、难冶炼的金属,成本较高。
答案:
问题二 如何认识铝热反应?
1. 铝热反应分析

2. 铝热反应实验
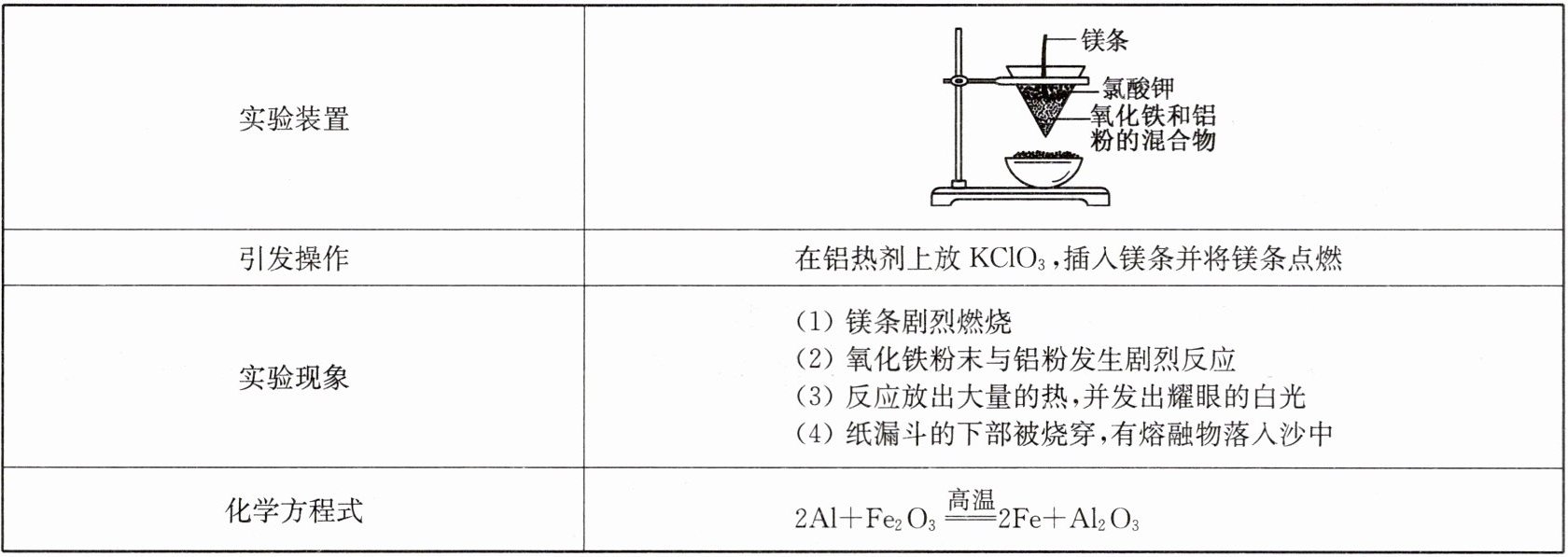
3. 铝热反应实验需注意的问题
(1) 要打磨干净镁带表面的氧化膜,否则难以点燃。
(2) 氧化铁粉末要干燥,铝粉没有被氧化,否则难以反应。
(3) 要保证纸漏斗重叠时四周均为四层,且内层纸漏斗一定要用水润湿,以防高温物质从四周溅出。
(4) 铝热反应是一个典型的放热反应,反应中放出的大量热量能够使铁熔化,所以要垫细沙,这样做的目的一是防止蒸发皿炸裂,二是防止熔融的金属溅出伤人。
(5) 实验装置应远离人群和易燃物。
1. 铝热反应分析

2. 铝热反应实验

3. 铝热反应实验需注意的问题
(1) 要打磨干净镁带表面的氧化膜,否则难以点燃。
(2) 氧化铁粉末要干燥,铝粉没有被氧化,否则难以反应。
(3) 要保证纸漏斗重叠时四周均为四层,且内层纸漏斗一定要用水润湿,以防高温物质从四周溅出。
(4) 铝热反应是一个典型的放热反应,反应中放出的大量热量能够使铁熔化,所以要垫细沙,这样做的目的一是防止蒸发皿炸裂,二是防止熔融的金属溅出伤人。
(5) 实验装置应远离人群和易燃物。
答案:
问题三 金属铜的冶炼。
1. 湿法炼铜
原理: Fe + CuSO₄ = FeSO₄ + Cu。
一般先用硫酸将铜矿中的铜元素转变为可溶性的硫酸铜,再将铁放入硫酸铜溶液中置换出铜。该方法设备简单、操作容易,常温下即可进行,节省燃料,但产出的铜杂质多。
2. 火法炼铜
原理: Cu₂S + O₂$\stackrel{高温}{=\!=\!=}$2Cu + SO₂。
一般将含硫铜矿焙烧脱去部分硫,再进一步制备粗铜。该方法涉及鼓风炉、反射炉、电炉等设备,产出的铜杂质相对较少,废气中含有 SO₂,易污染环境。
3. 生物炼铜(矿堆浸铜法)
原理: 借助某种能耐受铜盐毒性的细菌从矿石中提取铜。
CuS$\stackrel{细菌}{+\!O₂}$CuSO₄$\stackrel{Fe}{=\!=\!=}$Cu
特点: 成本低、污染小、反应条件简单等。

三、学业质量评价
基础篇
1. 湿法炼铜
原理: Fe + CuSO₄ = FeSO₄ + Cu。
一般先用硫酸将铜矿中的铜元素转变为可溶性的硫酸铜,再将铁放入硫酸铜溶液中置换出铜。该方法设备简单、操作容易,常温下即可进行,节省燃料,但产出的铜杂质多。
2. 火法炼铜
原理: Cu₂S + O₂$\stackrel{高温}{=\!=\!=}$2Cu + SO₂。
一般将含硫铜矿焙烧脱去部分硫,再进一步制备粗铜。该方法涉及鼓风炉、反射炉、电炉等设备,产出的铜杂质相对较少,废气中含有 SO₂,易污染环境。
3. 生物炼铜(矿堆浸铜法)
原理: 借助某种能耐受铜盐毒性的细菌从矿石中提取铜。
CuS$\stackrel{细菌}{+\!O₂}$CuSO₄$\stackrel{Fe}{=\!=\!=}$Cu
特点: 成本低、污染小、反应条件简单等。

三、学业质量评价
基础篇
答案:
查看更多完整答案,请扫码查看


