2025年新课程学习指导高中化学选择性必修1人教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年新课程学习指导高中化学选择性必修1人教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第89页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
由于电动汽车绿色环保,对环境友好,近几年发展势头强劲, 前景被广泛看好。电动汽车的动力是电池,那么原电池的工作原理是怎样的呢?


答案:
略。
1. 原电池的定义
将______转化为______的装置称为原电池。
将______转化为______的装置称为原电池。
答案:
化学能 电能
2. 原电池的工作原理
(1)锌铜原电池。

(2)锌铜原电池(含盐桥)。
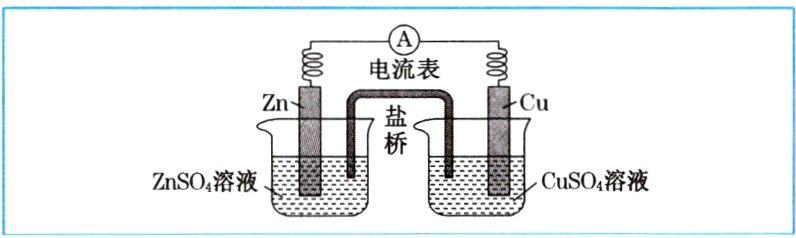

(1)锌铜原电池。

(2)锌铜原电池(含盐桥)。


答案:
①氧化 $Zn - 2e^{-}=Zn^{2 +}$ ②还原 $2H^{+}+2e^{-}=H_{2}\uparrow$ ③逐渐衰减
@@①负 $Zn - 2e^{-}=Zn^{2 +}$ ②正 $Cu^{2 +}+2e^{-}=Cu$ ③$Zn + Cu^{2 +}=Cu + Zn^{2 +}$ ④$ZnSO_{4}$ 负 $CuSO_{4}$ 正 ⑤负 正
@@①负 $Zn - 2e^{-}=Zn^{2 +}$ ②正 $Cu^{2 +}+2e^{-}=Cu$ ③$Zn + Cu^{2 +}=Cu + Zn^{2 +}$ ④$ZnSO_{4}$ 负 $CuSO_{4}$ 正 ⑤负 正
3. 原电池反应的条件
发生原电池反应的条件是自发进行的______。原电池输出电能的能力,取决于组成原电池的反应物的__________能力。
发生原电池反应的条件是自发进行的______。原电池输出电能的能力,取决于组成原电池的反应物的__________能力。
答案:
氧化还原反应 氧化还原
1. 正误判断(正确的打“√”,错误的打“×”)。
(1)原电池中正极发生氧化反应,负极发生还原反应。( )
(2)原电池的溶液中阴离子移向正极。( )
(3)原电池工作时,电子从负极流出,流入正极。( )
(4)盐桥中的盐可以是任意可溶于水的盐。( )
(1)原电池中正极发生氧化反应,负极发生还原反应。( )
(2)原电池的溶液中阴离子移向正极。( )
(3)原电池工作时,电子从负极流出,流入正极。( )
(4)盐桥中的盐可以是任意可溶于水的盐。( )
答案:
(1)×
(2)×
(3)√
(4)×
(1)×
(2)×
(3)√
(4)×
2. 下列示意图中能构成原电池的是( )


答案:
B
3. 锌铜原电池如下图所示,请回答下列问题:

(1)Zn发生__________反应,电极反应式为____________________。
(2)盐桥中的阳离子移向____(填“Cu”或“Zn”)极。
(3)电池总反应式为__________________________。
(4)Zn极减轻65 g时导线中转移的电子数为______。

(1)Zn发生__________反应,电极反应式为____________________。
(2)盐桥中的阳离子移向____(填“Cu”或“Zn”)极。
(3)电池总反应式为__________________________。
(4)Zn极减轻65 g时导线中转移的电子数为______。
答案:
(1)氧化 $Zn - 2e^{-}=Zn^{2 + }$
(2)Cu
(3)$Zn + Cu^{2 + }=Cu + Zn^{2 + }$
(4)$2N_{A}$
(1)氧化 $Zn - 2e^{-}=Zn^{2 + }$
(2)Cu
(3)$Zn + Cu^{2 + }=Cu + Zn^{2 + }$
(4)$2N_{A}$
某小组设计如下图装置(盐桥中装有浸泡了KNO₃溶液的琼脂)研究电化学原理。

(1)Mg、Ag分别作什么电极?写出两电极的反应式和原电池总反应式。
(2)盐桥中的K⁺、NO₃⁻的迁移方向是什么?
(3)外电路中电子流向是什么?

(1)Mg、Ag分别作什么电极?写出两电极的反应式和原电池总反应式。
(2)盐桥中的K⁺、NO₃⁻的迁移方向是什么?
(3)外电路中电子流向是什么?
答案:
(1)提示:Mg作负极,$Mg - 2e^{-}=Mg^{2 + }$;Ag作正极,$2Ag^{+}+2e^{-}=2Ag$。总反应式:$Mg + 2Ag^{+}=2Ag + Mg^{2 + }$。
(2)提示:$K^{+}$移向正极(或$AgNO_{3}$溶液),$NO_{3}^{-}$移向负极[或$Mg(NO_{3})_{2}$溶液]。
(3)提示:电子从Mg电极流出,通过外电路移向Ag电极。
(1)提示:Mg作负极,$Mg - 2e^{-}=Mg^{2 + }$;Ag作正极,$2Ag^{+}+2e^{-}=2Ag$。总反应式:$Mg + 2Ag^{+}=2Ag + Mg^{2 + }$。
(2)提示:$K^{+}$移向正极(或$AgNO_{3}$溶液),$NO_{3}^{-}$移向负极[或$Mg(NO_{3})_{2}$溶液]。
(3)提示:电子从Mg电极流出,通过外电路移向Ag电极。
1. 锌铜原电池(如图所示)工作时,下列叙述正确的是 ( )

A. 电池总反应为Zn + Cu²⁺ = Zn²⁺ + Cu
B. 该电池中电子由正极流向负极
C. 正极反应为Zn - 2e⁻ = Zn²⁺
D. 盐桥中的K⁺移向ZnSO₄溶液

A. 电池总反应为Zn + Cu²⁺ = Zn²⁺ + Cu
B. 该电池中电子由正极流向负极
C. 正极反应为Zn - 2e⁻ = Zn²⁺
D. 盐桥中的K⁺移向ZnSO₄溶液
答案:
A 由题图装置和金属的活动性顺序可知,该原电池中Zn为负极,其电极反应为$Zn - 2e^{-}=Zn^{2 + }$,Cu为正极,其电极反应为$Cu^{2 + }+2e^{-}=Cu$,电池总反应为$Zn + Cu^{2 + }=Zn^{2 + }+Cu$。外电路中,电子由负极流向正极。原电池中阳离子向正极移动,所以盐桥中的$K^{+}$移向$CuSO_{4}$溶液。
2. 原电池的电极反应式不仅与电极材料的性质有关,也与电解质溶液有关。下列说法错误的是 ( )
A. 由Fe、Cu、FeCl₃溶液组成的原电池,负极反应式为Cu - 2e⁻ = Cu²⁺
B. 由Al、Cu、稀硫酸组成的原电池,负极反应式为Al - 3e⁻ = Al³⁺
C. 由Al、Mg、NaOH溶液组成的原电池,负极反应式为Al + 4OH⁻ - 3e⁻ = [Al(OH)₄]⁻
D. 由Al、Cu、浓硝酸组成的原电池,负极反应式为Cu - 2e⁻ = Cu²⁺
A. 由Fe、Cu、FeCl₃溶液组成的原电池,负极反应式为Cu - 2e⁻ = Cu²⁺
B. 由Al、Cu、稀硫酸组成的原电池,负极反应式为Al - 3e⁻ = Al³⁺
C. 由Al、Mg、NaOH溶液组成的原电池,负极反应式为Al + 4OH⁻ - 3e⁻ = [Al(OH)₄]⁻
D. 由Al、Cu、浓硝酸组成的原电池,负极反应式为Cu - 2e⁻ = Cu²⁺
答案:
A 铁比铜活泼,铁为负极,负极反应式为$Fe - 2e^{-}=Fe^{2 + }$,故A错误;铝比铜活泼,铝为负极,负极反应式为$Al - 3e^{-}=Al^{3 + }$,故B正确;虽然镁比铝活泼,但镁不与氢氧化钠溶液反应,因此铝为负极,负极反应式为$Al + 4OH^{-}-3e^{-}=[Al(OH)_{4}]^{-}$,故C正确;Al遇浓硝酸发生钝化反应,则铜为负极,负极反应式为$Cu - 2e^{-}=Cu^{2 + }$,故D正确。
1. 实验室制H₂时,往往使用粗锌与稀硫酸反应,其原理是什么?
答案:
提示:粗锌中含其他金属,可与Zn、稀硫酸构成原电池,使反应加快。
2. 在稀硫酸作为电解质溶液,A、B作为两极材料的原电池反应时,A电极溶解,则A、B电极中哪个为负极?两者谁更活泼?
答案:
提示:A为负极,A更活泼。
3. 设计原电池:Cu + 2Ag⁺ = 2Ag + Cu²⁺。画出简易原电池装置,注明电极材料和电解质溶液成分。
答案:
提示:

提示:

1. 把a、b、c、d四种金属浸入稀硫酸中,用导线两两相连组成原电池。a、b相连时,a为负极;c、d相连时,电流由d流向c;a、c相连时,c极上产生大量气泡;b、d相连时,b极上产生大量气泡。四种金属的活动性顺序为 ( )
A. a>b>c>d
B. a>c>d>b
C. c>a>b>d
D. b>d>c>a
A. a>b>c>d
B. a>c>d>b
C. c>a>b>d
D. b>d>c>a
答案:
B a、b相连时,a为负极,说明活动性a>b;c、d相连时,电流由正极流向负极,d为正极,说明活动性c>d;a、c相连时,正极产生气泡,c为正极,说明活动性a>c;b、d相连时,b为正极,说明活动性d>b。综上可知,活动性a>c>d>b。
2. 某原电池总反应为Cu + 2Fe³⁺ = Cu²⁺ + 2Fe²⁺,下列能实现该反应的原电池是 ( )


答案:
D 锌比铜活泼,锌为负极,电池反应为$Zn + 2Fe^{3 + }=Zn^{2 + }+2Fe^{2 + }$,A项错误;金属铜和亚铁盐不反应,没有自发进行的氧化还原反应,B项错误;锌比铁活泼,锌为负极,电池反应为$Zn + Cu^{2 + }=Zn^{2 + }+Cu$,C项错误;铜比银活泼,金属铜为负极,电池反应为$Cu + 2Fe^{3 + }=Cu^{2 + }+2Fe^{2 + }$,D项正确。
3. 设计原电池Zn + 2Fe³⁺ = Zn²⁺ + 2Fe²⁺,在方框中画出能形成稳定电流的半电池形式的装置图(标出电极材料、电解质溶液)。

负极:________,电极反应:________________;
正极:________,电极反应:________________。

负极:________,电极反应:________________;
正极:________,电极反应:________________。
答案:
解析:分析元素化合价的变化可知,Zn为负极,比Zn活泼性差的金属或非金属(石墨等)为正极,选择与电极材料有相同离子的溶液作电解质溶液。
答案:

$Zn$ $Zn - 2e^{-}=Zn^{2 + }$ $Pt$ $2Fe^{3 + }+2e^{-}=2Fe^{2 + }$
解析:分析元素化合价的变化可知,Zn为负极,比Zn活泼性差的金属或非金属(石墨等)为正极,选择与电极材料有相同离子的溶液作电解质溶液。
答案:

$Zn$ $Zn - 2e^{-}=Zn^{2 + }$ $Pt$ $2Fe^{3 + }+2e^{-}=2Fe^{2 + }$
查看更多完整答案,请扫码查看


