2025年新课程学习指导高中化学选择性必修1人教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年新课程学习指导高中化学选择性必修1人教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第10页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
(二)用盖斯定律计算反应热的示例
[示例1]
已知:①C(s)+O₂(g)=CO₂(g) $\Delta H_{1}=-393.5\ kJ\cdot mol^{-1}$②CO(g)+$\frac{1}{2}$O₂(g)=CO₂(g) $\Delta H_{2}=-283.0\ kJ\cdot mol^{-1}$
若C(s)+$\frac{1}{2}$O₂(g)=CO(g)的反应热为$\Delta H_{3}$,求$\Delta H_{3}$。
1. 虚拟路径法

根据盖斯定律有:$\Delta H_{1}=$____________________。
则$\Delta H_{3}=$______________________________。
2. 加和法
反应①=目标反应+反应②。
$\Delta H_{3}=$______________ = __________________。
[示例2]
已知C(s)+O₂(g)=CO₂(g) $\Delta H = a\ kJ\cdot mol^{-1}$,则CO₂(g)=C(s)+O₂(g)的$\Delta H'=$______________。
[微点拨] 对于无法通过实验测定或较难通过实验测定的反应的焓变,可应用盖斯定律计算求得。
答案:
$\Delta H_{2}+\Delta H_{3}$ $\Delta H_{1}-\Delta H_{2}=-393.5\ kJ\cdot mol^{-1}-(-283.0\ kJ\cdot mol^{-1})=-110.5\ kJ\cdot mol^{-1}$
@@$\Delta H_{1}-\Delta H_{2}$ $-110.5\ kJ\cdot mol^{-1}$
@@$-a\ kJ\cdot mol^{-1}$
@@$\Delta H_{1}-\Delta H_{2}$ $-110.5\ kJ\cdot mol^{-1}$
@@$-a\ kJ\cdot mol^{-1}$
1. 判断正误(正确的打“√”,错误的打“×”)。
(1)一个反应一步完成或分几步完成,两者相比,经过的步骤越多,放出的热量越多。( )
(2)所有化学反应的反应热都可以通过实验测定。( )
(3)在 中,存在关系式:$\Delta H_{1}=\Delta H_{2}+\Delta H_{3}$。( )
中,存在关系式:$\Delta H_{1}=\Delta H_{2}+\Delta H_{3}$。( )
(1)一个反应一步完成或分几步完成,两者相比,经过的步骤越多,放出的热量越多。( )
(2)所有化学反应的反应热都可以通过实验测定。( )
(3)在
 中,存在关系式:$\Delta H_{1}=\Delta H_{2}+\Delta H_{3}$。( )
中,存在关系式:$\Delta H_{1}=\Delta H_{2}+\Delta H_{3}$。( )
答案:
(1)×
(2)×
(3)×
(1)×
(2)×
(3)×
2. 下列关于盖斯定律描述不正确的是( )
A. 化学反应的反应热不仅与反应体系的始态和终态有关,也与反应的途径有关
B. 盖斯定律遵守能量守恒定律
C. 利用盖斯定律可计算通过实验难测定的反应的反应热
D. 利用盖斯定律可以计算有副反应发生的反应的反应热
A. 化学反应的反应热不仅与反应体系的始态和终态有关,也与反应的途径有关
B. 盖斯定律遵守能量守恒定律
C. 利用盖斯定律可计算通过实验难测定的反应的反应热
D. 利用盖斯定律可以计算有副反应发生的反应的反应热
答案:
A
3. 已知$H_{2}(g)+\frac{1}{2}O_{2}(g)\xlongequal{\;\;}H_{2}O(g)$ $\Delta H=-a\ kJ\cdot mol^{-1}$,则
(1)$2H_{2}(g)+O_{2}(g)\xlongequal{\;\;}2H_{2}O(g)$ $\Delta H_{1}=$______ $kJ\cdot mol^{-1}$。
(2)$H_{2}O(g)\xlongequal{\;\;}H_{2}(g)+\frac{1}{2}O_{2}(g)$ $\Delta H_{2}=$____ $kJ\cdot mol^{-1}$。
(1)$2H_{2}(g)+O_{2}(g)\xlongequal{\;\;}2H_{2}O(g)$ $\Delta H_{1}=$______ $kJ\cdot mol^{-1}$。
(2)$H_{2}O(g)\xlongequal{\;\;}H_{2}(g)+\frac{1}{2}O_{2}(g)$ $\Delta H_{2}=$____ $kJ\cdot mol^{-1}$。
答案:
(1)$-2a$
(2)$+a$
(1)$-2a$
(2)$+a$
(1)(2023·全国甲卷·节选)甲烷选择性氧化制备甲醇是一种原子利用率高的方法。回答下列问题:
已知下列反应的热化学方程式:
①$3O_{2}(g)=2O_{3}(g)$ $\Delta H_{1}=+285kJ\cdot mol^{-1}$
②$2CH_{4}(g)+O_{2}(g)=2CH_{3}OH(l)$ $\Delta H_{2}=-329kJ\cdot mol^{-1}$
反应③$CH_{4}(g)+O_{3}(g)=CH_{3}OH(l)+O_{2}(g)$的$\Delta H_{3}=$______$kJ\cdot mol^{-1}$。
(2)(2022·全国乙卷·节选)已知下列反应的热化学方程式:
①$2H_{2}S(g)+3O_{2}(g)=2SO_{2}(g)+2H_{2}O(g)$ $\Delta H_{1}=-1036kJ\cdot mol^{-1}$
②$4H_{2}S(g)+2SO_{2}(g)=3S_{2}(g)+4H_{2}O(g)$ $\Delta H_{2}=+94kJ\cdot mol^{-1}$
③$2H_{2}(g)+O_{2}(g)=2H_{2}O(g)$ $\Delta H_{3}=-484kJ\cdot mol^{-1}$
计算$H_{2}S$热分解反应④$2H_{2}S(g)=S_{2}(g)+2H_{2}(g)$的$\Delta H_{4}=$______$kJ\cdot mol^{-1}$。
已知下列反应的热化学方程式:
①$3O_{2}(g)=2O_{3}(g)$ $\Delta H_{1}=+285kJ\cdot mol^{-1}$
②$2CH_{4}(g)+O_{2}(g)=2CH_{3}OH(l)$ $\Delta H_{2}=-329kJ\cdot mol^{-1}$
反应③$CH_{4}(g)+O_{3}(g)=CH_{3}OH(l)+O_{2}(g)$的$\Delta H_{3}=$______$kJ\cdot mol^{-1}$。
(2)(2022·全国乙卷·节选)已知下列反应的热化学方程式:
①$2H_{2}S(g)+3O_{2}(g)=2SO_{2}(g)+2H_{2}O(g)$ $\Delta H_{1}=-1036kJ\cdot mol^{-1}$
②$4H_{2}S(g)+2SO_{2}(g)=3S_{2}(g)+4H_{2}O(g)$ $\Delta H_{2}=+94kJ\cdot mol^{-1}$
③$2H_{2}(g)+O_{2}(g)=2H_{2}O(g)$ $\Delta H_{3}=-484kJ\cdot mol^{-1}$
计算$H_{2}S$热分解反应④$2H_{2}S(g)=S_{2}(g)+2H_{2}(g)$的$\Delta H_{4}=$______$kJ\cdot mol^{-1}$。
答案:
(1)$-307$
(2)$+170$
(1)$-307$
(2)$+170$
1. 已知:①$2C(s)+O_{2}(g)=2CO(g)$ $\Delta H=-220kJ\cdot mol^{-1}$
②氢气燃烧的能量变化示意图如下图所示:
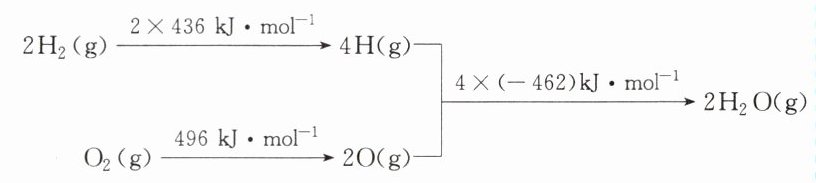
下列说法正确的是( )
A. $1molC(s)$完全燃烧放出$110kJ$的热量
B. $H_{2}(g)+\frac{1}{2}O_{2}(g)=H_{2}O(g)$ $\Delta H=+240kJ\cdot mol^{-1}$
C. $C(s)+H_{2}O(g)=CO(g)+H_{2}(g)$ $\Delta H=+130kJ\cdot mol^{-1}$
D. 欲分解$2molH_{2}O(l)$,至少需要提供$4\times462kJ$的热量
②氢气燃烧的能量变化示意图如下图所示:

下列说法正确的是( )
A. $1molC(s)$完全燃烧放出$110kJ$的热量
B. $H_{2}(g)+\frac{1}{2}O_{2}(g)=H_{2}O(g)$ $\Delta H=+240kJ\cdot mol^{-1}$
C. $C(s)+H_{2}O(g)=CO(g)+H_{2}(g)$ $\Delta H=+130kJ\cdot mol^{-1}$
D. 欲分解$2molH_{2}O(l)$,至少需要提供$4\times462kJ$的热量
答案:
C $1\text{mol C(s)}$燃烧生成$CO$气体时放出$110\text{kJ}$热量,此时不是完全燃烧,A项错误;根据氢气燃烧的能量变化示意图,可得热化学方程式$2H_{2}(g)+O_{2}(g)=2H_{2}O(g)$ $\Delta H=-480\text{kJ}\cdot\text{mol}^{-1}$ ②,故$H_{2}(g)+\frac{1}{2}O_{2}(g)=H_{2}O(g)$ $\Delta H=-240\text{kJ}\cdot\text{mol}^{-1}$,B项错误;根据盖斯定律,由$\frac{1}{2}\times($① - ②$)$可得目标热化学方程式$C(s)+H_{2}O(g)=CO(g)+H_{2}(g)$ $\Delta H= + 130\text{kJ}\cdot\text{mol}^{-1}$,C项正确;由题图中信息可知,分解$2\text{mol }H_{2}O(g)$至少需要提供$4\times462\text{kJ}$的热量,而分解$2\text{mol }H_{2}O(l)$需要提供的热量更多,D项错误。
2. (1)已知:① +$H_{2}(g)$ $\Delta H_{1}=+100.3kJ\cdot mol^{-1}$
+$H_{2}(g)$ $\Delta H_{1}=+100.3kJ\cdot mol^{-1}$
②$H_{2}(g)+I_{2}(g)=2HI(g)$ $\Delta H_{2}=-11.0kJ\cdot mol^{-1}$
对于反应:③ +$I_{2}$(g)=
+$I_{2}$(g)= (g)+$2HI(g)$ $\Delta H_{3}=$______$kJ\cdot mol^{-1}$。
(g)+$2HI(g)$ $\Delta H_{3}=$______$kJ\cdot mol^{-1}$。
(2)已知:$2N_{2}O_{5}(g)=2N_{2}O_{4}(g)+O_{2}(g)$ $\Delta H_{1}=-4.4kJ\cdot mol^{-1}$
$2NO_{2}(g)=N_{2}O_{4}(g)$ $\Delta H_{2}=-55.3kJ\cdot mol^{-1}$
则反应$N_{2}O_{5}(g)=2NO_{2}(g)+\frac{1}{2}O_{2}(g)$的$\Delta H=$______$kJ\cdot mol^{-1}$。
 +$H_{2}(g)$ $\Delta H_{1}=+100.3kJ\cdot mol^{-1}$
+$H_{2}(g)$ $\Delta H_{1}=+100.3kJ\cdot mol^{-1}$②$H_{2}(g)+I_{2}(g)=2HI(g)$ $\Delta H_{2}=-11.0kJ\cdot mol^{-1}$
对于反应:③
 +$I_{2}$(g)=
+$I_{2}$(g)= (g)+$2HI(g)$ $\Delta H_{3}=$______$kJ\cdot mol^{-1}$。
(g)+$2HI(g)$ $\Delta H_{3}=$______$kJ\cdot mol^{-1}$。(2)已知:$2N_{2}O_{5}(g)=2N_{2}O_{4}(g)+O_{2}(g)$ $\Delta H_{1}=-4.4kJ\cdot mol^{-1}$
$2NO_{2}(g)=N_{2}O_{4}(g)$ $\Delta H_{2}=-55.3kJ\cdot mol^{-1}$
则反应$N_{2}O_{5}(g)=2NO_{2}(g)+\frac{1}{2}O_{2}(g)$的$\Delta H=$______$kJ\cdot mol^{-1}$。
答案:
(1)$+89.3$
(2)$+53.1$
(1)$+89.3$
(2)$+53.1$
3. (1)已知:
①$H_{2}(g)+\frac{1}{2}O_{2}(g)=H_{2}O(g)$ $\Delta H=-241.8kJ\cdot mol^{-1}$
②$C(s)+\frac{1}{2}O_{2}(g)=CO(g)$ $\Delta H=-110.5kJ\cdot mol^{-1}$
写出焦炭与水蒸气反应的热化学方程式:______。
(2)焙烧产生的$SO_{2}$可用于制硫酸。已知$25^{\circ}C$、$101kPa$时:
①$2SO_{2}(g)+O_{2}(g)=2SO_{3}(g)$ $\Delta H_{1}=-197kJ\cdot mol^{-1}$
②$H_{2}O(g)=H_{2}O(l)$ $\Delta H_{2}=-44kJ\cdot mol^{-1}$
③$2SO_{2}(g)+O_{2}(g)+2H_{2}O(g)=2H_{2}SO_{4}(l)$ $\Delta H_{3}=-545kJ\cdot mol^{-1}$
则$SO_{3}(g)$与$H_{2}O(l)$反应的热化学方程式是______。
①$H_{2}(g)+\frac{1}{2}O_{2}(g)=H_{2}O(g)$ $\Delta H=-241.8kJ\cdot mol^{-1}$
②$C(s)+\frac{1}{2}O_{2}(g)=CO(g)$ $\Delta H=-110.5kJ\cdot mol^{-1}$
写出焦炭与水蒸气反应的热化学方程式:______。
(2)焙烧产生的$SO_{2}$可用于制硫酸。已知$25^{\circ}C$、$101kPa$时:
①$2SO_{2}(g)+O_{2}(g)=2SO_{3}(g)$ $\Delta H_{1}=-197kJ\cdot mol^{-1}$
②$H_{2}O(g)=H_{2}O(l)$ $\Delta H_{2}=-44kJ\cdot mol^{-1}$
③$2SO_{2}(g)+O_{2}(g)+2H_{2}O(g)=2H_{2}SO_{4}(l)$ $\Delta H_{3}=-545kJ\cdot mol^{-1}$
则$SO_{3}(g)$与$H_{2}O(l)$反应的热化学方程式是______。
答案:
(1)$C(s)+H_{2}O(g)=CO(g)+H_{2}(g)$ $\Delta H= + 131.3\text{kJ}\cdot\text{mol}^{-1}$
(2)$SO_{3}(g)+H_{2}O(l)=H_{2}SO_{4}(l)$ $\Delta H=-130\text{kJ}\cdot\text{mol}^{-1}$
(1)$C(s)+H_{2}O(g)=CO(g)+H_{2}(g)$ $\Delta H= + 131.3\text{kJ}\cdot\text{mol}^{-1}$
(2)$SO_{3}(g)+H_{2}O(l)=H_{2}SO_{4}(l)$ $\Delta H=-130\text{kJ}\cdot\text{mol}^{-1}$
在同温同压下,下列各组热化学方程式中,$Q_{2}>Q_{1}$的是( )
A. $2H_{2}(g)+O_{2}(g)=2H_{2}O(l)$ $\Delta H=-Q_{1}kJ\cdot mol^{-1}$
$2H_{2}(g)+O_{2}(g)=2H_{2}O(g)$ $\Delta H=-Q_{2}kJ\cdot mol^{-1}$
B. $S(g)+O_{2}(g)=SO_{2}(g)$ $\Delta H=-Q_{1}kJ\cdot mol^{-1}$
$S(s)+O_{2}(g)=SO_{2}(g)$ $\Delta H=-Q_{2}kJ\cdot mol^{-1}$
C. $C(s)+\frac{1}{2}O_{2}(g)=CO(g)$ $\Delta H=-Q_{1}kJ\cdot mol^{-1}$
$C(s)+O_{2}(g)=CO_{2}(g)$ $\Delta H=-Q_{2}kJ\cdot mol^{-1}$
D. $H_{2}(g)+Cl_{2}(g)=2HCl(g)$ $\Delta H=-Q_{1}kJ\cdot mol^{-1}$
$\frac{1}{2}H_{2}(g)+\frac{1}{2}Cl_{2}(g)=HCl(g)$ $\Delta H=-Q_{2}kJ\cdot mol^{-1}$
A. $2H_{2}(g)+O_{2}(g)=2H_{2}O(l)$ $\Delta H=-Q_{1}kJ\cdot mol^{-1}$
$2H_{2}(g)+O_{2}(g)=2H_{2}O(g)$ $\Delta H=-Q_{2}kJ\cdot mol^{-1}$
B. $S(g)+O_{2}(g)=SO_{2}(g)$ $\Delta H=-Q_{1}kJ\cdot mol^{-1}$
$S(s)+O_{2}(g)=SO_{2}(g)$ $\Delta H=-Q_{2}kJ\cdot mol^{-1}$
C. $C(s)+\frac{1}{2}O_{2}(g)=CO(g)$ $\Delta H=-Q_{1}kJ\cdot mol^{-1}$
$C(s)+O_{2}(g)=CO_{2}(g)$ $\Delta H=-Q_{2}kJ\cdot mol^{-1}$
D. $H_{2}(g)+Cl_{2}(g)=2HCl(g)$ $\Delta H=-Q_{1}kJ\cdot mol^{-1}$
$\frac{1}{2}H_{2}(g)+\frac{1}{2}Cl_{2}(g)=HCl(g)$ $\Delta H=-Q_{2}kJ\cdot mol^{-1}$
答案:
C A项中的反应可虚拟为 ,根据盖斯定律$Q_{1}=Q_{2}+Q$,故$Q_{1}>Q_{2}$。B项中的反应可虚拟为
,根据盖斯定律$Q_{1}=Q_{2}+Q$,故$Q_{1}>Q_{2}$。B项中的反应可虚拟为 ,则$Q_{2}=Q_{1}-Q$,故$Q_{1}>Q_{2}$。C项中的反应可虚拟为
,则$Q_{2}=Q_{1}-Q$,故$Q_{1}>Q_{2}$。C项中的反应可虚拟为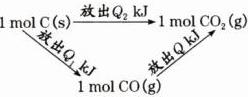
,则$Q_{2}=Q_{1}+Q$,故$Q_{2}>Q_{1}$。D项中$Q_{1}=2Q_{2}$,即$Q_{1}>Q_{2}$。
C A项中的反应可虚拟为
 ,根据盖斯定律$Q_{1}=Q_{2}+Q$,故$Q_{1}>Q_{2}$。B项中的反应可虚拟为
,根据盖斯定律$Q_{1}=Q_{2}+Q$,故$Q_{1}>Q_{2}$。B项中的反应可虚拟为 ,则$Q_{2}=Q_{1}-Q$,故$Q_{1}>Q_{2}$。C项中的反应可虚拟为
,则$Q_{2}=Q_{1}-Q$,故$Q_{1}>Q_{2}$。C项中的反应可虚拟为
,则$Q_{2}=Q_{1}+Q$,故$Q_{2}>Q_{1}$。D项中$Q_{1}=2Q_{2}$,即$Q_{1}>Q_{2}$。
1. 已知:a.$C_{2}H_{2}(g)+H_{2}(g)=C_{2}H_{4}(g)$ $\Delta H<0$;b.$2CH_{4}(g)=C_{2}H_{4}(g)+2H_{2}(g)$ $\Delta H>0$。
以下3个热化学方程式:
①$C(s)+2H_{2}(g)=CH_{4}(g)$ $\Delta H_{1}$
②$C(s)+\frac{1}{2}H_{2}(g)=\frac{1}{2}C_{2}H_{2}(g)$ $\Delta H_{2}$
③$C(s)+H_{2}(g)=\frac{1}{2}C_{2}H_{4}(g)$ $\Delta H_{3}$
$\Delta H_{1}$、$\Delta H_{2}$、$\Delta H_{3}$由大到小的顺序是( )
A. $\Delta H_{2}>\Delta H_{3}>\Delta H_{1}$
B. $\Delta H_{3}>\Delta H_{2}>\Delta H_{1}$
C. $\Delta H_{3}>\Delta H_{1}>\Delta H_{2}$
D. $\Delta H_{1}>\Delta H_{2}>\Delta H_{3}$
以下3个热化学方程式:
①$C(s)+2H_{2}(g)=CH_{4}(g)$ $\Delta H_{1}$
②$C(s)+\frac{1}{2}H_{2}(g)=\frac{1}{2}C_{2}H_{2}(g)$ $\Delta H_{2}$
③$C(s)+H_{2}(g)=\frac{1}{2}C_{2}H_{4}(g)$ $\Delta H_{3}$
$\Delta H_{1}$、$\Delta H_{2}$、$\Delta H_{3}$由大到小的顺序是( )
A. $\Delta H_{2}>\Delta H_{3}>\Delta H_{1}$
B. $\Delta H_{3}>\Delta H_{2}>\Delta H_{1}$
C. $\Delta H_{3}>\Delta H_{1}>\Delta H_{2}$
D. $\Delta H_{1}>\Delta H_{2}>\Delta H_{3}$
答案:
A 利用盖斯定律,$(② - ③)\times2$得出$C_{2}H_{4}(g)=C_{2}H_{2}(g)+H_{2}(g)$ $\Delta H=2(\Delta H_{2}-\Delta H_{3})$,根据反应a的逆过程为吸热反应,得$\Delta H_{2}-\Delta H_{3}>0$,$\Delta H_{2}>\Delta H_{3}$;$(③ - ①)\times2$得出$2CH_{4}(g)=C_{2}H_{4}(g)+2H_{2}(g)$ $\Delta H=2(\Delta H_{3}-\Delta H_{1})$,根据反应b,得$\Delta H_{3}-\Delta H_{1}>0$,$\Delta H_{3}>\Delta H_{1}$。因此A项正确。
2. 假设反应体系的始态为甲,中间态为乙,终态为丙,它们之间的变化如上图所示,则下列说法不正确的是( )
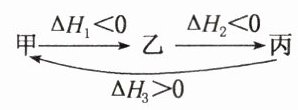
A. $|\Delta H_{1}|>|\Delta H_{2}|$
B. $|\Delta H_{1}|<|\Delta H_{3}|$
C. $\Delta H_{1}+\Delta H_{2}+\Delta H_{3}=0$
D. 甲→丙的$\Delta H=\Delta H_{1}+\Delta H_{2}$

A. $|\Delta H_{1}|>|\Delta H_{2}|$
B. $|\Delta H_{1}|<|\Delta H_{3}|$
C. $\Delta H_{1}+\Delta H_{2}+\Delta H_{3}=0$
D. 甲→丙的$\Delta H=\Delta H_{1}+\Delta H_{2}$
答案:
A 题述过程中甲为始态,乙为中间态,丙为终态,由盖斯定律可知,甲→丙的$\Delta H=\Delta H_{1}+\Delta H_{2}$,D项正确;在题述过程中$\Delta H_{1}$与$\Delta H_{2}$的相对大小无法判断,A项错误;由$|\Delta H_{3}|=|\Delta H_{1}|+|\Delta H_{2}|$知,$|\Delta H_{1}|<|\Delta H_{3}|$,B项正确;从能量守恒的角度可知,$\Delta H_{1}+\Delta H_{2}+\Delta H_{3}=0$,C项正确。
3. $2mol$金属钠和$1mol$氯气反应的能量关系如右上图所示,下列说法不正确的是( )
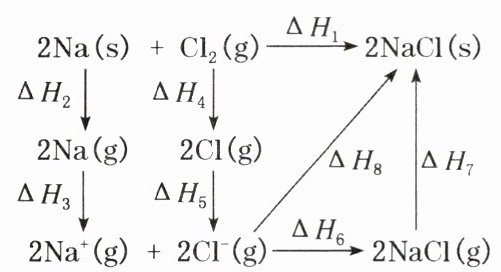
A. $\Delta H_{2}>0$
B. $\Delta H_{4}+\Delta H_{5}+\Delta H_{8}=\Delta H_{1}$
C. 在相同条件下,$2K(g)\to2K^{+}(g)$的$\Delta H_{3}'<\Delta H_{3}$
D. $\Delta H_{6}+\Delta H_{7}=\Delta H_{8}$

A. $\Delta H_{2}>0$
B. $\Delta H_{4}+\Delta H_{5}+\Delta H_{8}=\Delta H_{1}$
C. 在相同条件下,$2K(g)\to2K^{+}(g)$的$\Delta H_{3}'<\Delta H_{3}$
D. $\Delta H_{6}+\Delta H_{7}=\Delta H_{8}$
答案:
B $Na$从固态变为气态的过程中需要吸收热量,则$\Delta H_{2}>0$,A正确;由盖斯定律可知,$\Delta H_{2}+\Delta H_{3}+\Delta H_{4}+\Delta H_{5}+\Delta H_{8}=\Delta H_{1}$,B错误;钾原子原子核外有4个电子层,其失去最外层一个电子所需的能量较小,则$2K(g)=2K^{+}(g)$的$\Delta H_{3}'<\Delta H_{3}$,C正确;由盖斯定律可知,$\Delta H_{6}+\Delta H_{7}=\Delta H_{8}$,D正确。
查看更多完整答案,请扫码查看


