2025年新课程学习指导高中化学选择性必修1人教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年新课程学习指导高中化学选择性必修1人教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第82页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
(二)沉淀的转化
1. 沉淀转化原理分析
AgCl转化为AgI的反应原理分析:
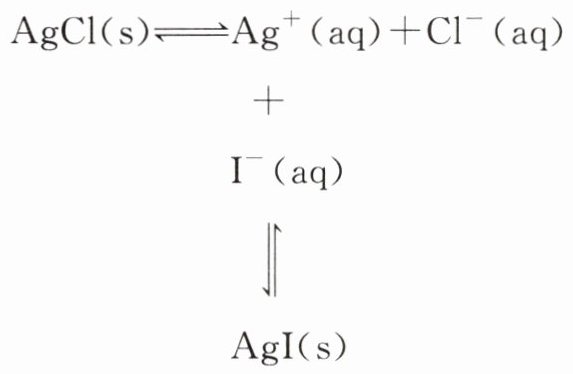
当向AgCl沉淀中滴加KI溶液时,溶液中Q(AgI)=c(Ag⁺)·c(I⁻)大于Kₛₚ(AgI),生成AgI沉淀,导致AgCl的溶解平衡向________的方向移动,实现了AgCl转化成AgI,其转化离子方程式为________________。
2. 沉淀转化的实质
沉淀转化的实质就是________________。
一般来说,溶解度________的沉淀转化为溶解度________的沉淀容易实现。两者的溶解度差别越大,转化越________。
3. 沉淀转化的应用价值
(1)水垢中含有的CaSO₄用酸不能溶解。为了除去水垢中的CaSO₄,可先用________溶液处理,使CaSO₄转化为疏松、易溶于酸的________(CaCO₃、CaSO₄的Kₛₚ分别为3.4×10⁻⁹、4.9×10⁻⁵),然后用______除去。上述过程的离子方程式有CaSO₄(s)+CO₃²⁻(aq)⇌CaCO₃(s)+SO₄²⁻(aq),CaCO₃+2H⁺=Ca²⁺+CO₂↑+H₂O。
(2)各种原生铜的硫化物经氧化、淋滤作用后可变成CuSO₄溶液,并向深部渗透,遇到深层的闪锌矿(ZnS)和方铅矿(PbS),便慢慢地使它们转化为铜蓝(CuS)。
(3)研究发现,在饮用水、食物或牙膏中添加氟化物,能起到预防龋齿的作用。这是因为氟离子能与羟基磷灰石发生反应,生成氟磷灰石[Ca₅(PO₄)₃F]:Ca₅(PO₄)₃OH(s)+F⁻(aq)⇌Ca₅(PO₄)₃F(s)+OH⁻(aq)。
1. 沉淀转化原理分析
AgCl转化为AgI的反应原理分析:
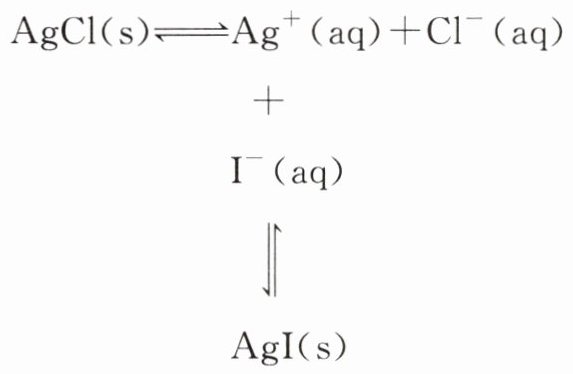
当向AgCl沉淀中滴加KI溶液时,溶液中Q(AgI)=c(Ag⁺)·c(I⁻)大于Kₛₚ(AgI),生成AgI沉淀,导致AgCl的溶解平衡向________的方向移动,实现了AgCl转化成AgI,其转化离子方程式为________________。
2. 沉淀转化的实质
沉淀转化的实质就是________________。
一般来说,溶解度________的沉淀转化为溶解度________的沉淀容易实现。两者的溶解度差别越大,转化越________。
3. 沉淀转化的应用价值
(1)水垢中含有的CaSO₄用酸不能溶解。为了除去水垢中的CaSO₄,可先用________溶液处理,使CaSO₄转化为疏松、易溶于酸的________(CaCO₃、CaSO₄的Kₛₚ分别为3.4×10⁻⁹、4.9×10⁻⁵),然后用______除去。上述过程的离子方程式有CaSO₄(s)+CO₃²⁻(aq)⇌CaCO₃(s)+SO₄²⁻(aq),CaCO₃+2H⁺=Ca²⁺+CO₂↑+H₂O。
(2)各种原生铜的硫化物经氧化、淋滤作用后可变成CuSO₄溶液,并向深部渗透,遇到深层的闪锌矿(ZnS)和方铅矿(PbS),便慢慢地使它们转化为铜蓝(CuS)。
(3)研究发现,在饮用水、食物或牙膏中添加氟化物,能起到预防龋齿的作用。这是因为氟离子能与羟基磷灰石发生反应,生成氟磷灰石[Ca₅(PO₄)₃F]:Ca₅(PO₄)₃OH(s)+F⁻(aq)⇌Ca₅(PO₄)₃F(s)+OH⁻(aq)。
答案:
溶解 $I^{-}(aq)+AgCl(s)\rightleftharpoons AgI(s)+Cl^{-}(aq)$
@@沉淀溶解平衡的移动
@@小 更小 容易
@@$Na_{2}CO_{3}$ $CaCO_{3}$ 酸
@@沉淀溶解平衡的移动
@@小 更小 容易
@@$Na_{2}CO_{3}$ $CaCO_{3}$ 酸
1.正误判断(正确的打“√”,错误的打“×”)。
(1)难溶物只能转化为溶解度更小的物质。( )
(2)在化工生产中除去废水中的Cu²⁺,可选用Na₂S作沉淀剂。( )
(3)为减小洗涤过程中固体的损失,最好选用稀硫酸代替H₂O来洗涤BaSO₄沉淀。( )
(1)难溶物只能转化为溶解度更小的物质。( )
(2)在化工生产中除去废水中的Cu²⁺,可选用Na₂S作沉淀剂。( )
(3)为减小洗涤过程中固体的损失,最好选用稀硫酸代替H₂O来洗涤BaSO₄沉淀。( )
答案:
(1)×
(2)√
(3)√
(1)×
(2)√
(3)√
2.下列说法中正确的是( )
A.钡中毒患者可尽快使用苏打溶液洗胃,随即导泻使Ba²⁺转化为BaCO₃而排出
B.工业上可以用NaHS、(NH₄)₂S等可溶性硫化物作沉淀剂除去废水中的Hg²⁺、Cu²⁺等,但不能使用FeS等不溶性硫化物作沉淀剂
C.水中的Mg(HCO₃)₂、Ca(HCO₃)₂受热易分解生成难溶性的MgCO₃、CaCO₃,故水垢的主要成分是MgCO₃、CaCO₃
D.珊瑚虫从周围海水中获取Ca²⁺和HCO₃⁻,经反应形成石灰石(CaCO₃)外壳,从而逐渐形成珊瑚
A.钡中毒患者可尽快使用苏打溶液洗胃,随即导泻使Ba²⁺转化为BaCO₃而排出
B.工业上可以用NaHS、(NH₄)₂S等可溶性硫化物作沉淀剂除去废水中的Hg²⁺、Cu²⁺等,但不能使用FeS等不溶性硫化物作沉淀剂
C.水中的Mg(HCO₃)₂、Ca(HCO₃)₂受热易分解生成难溶性的MgCO₃、CaCO₃,故水垢的主要成分是MgCO₃、CaCO₃
D.珊瑚虫从周围海水中获取Ca²⁺和HCO₃⁻,经反应形成石灰石(CaCO₃)外壳,从而逐渐形成珊瑚
答案:
D
查看更多完整答案,请扫码查看


