2025年新课程学习指导高中化学选择性必修1人教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年新课程学习指导高中化学选择性必修1人教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第42页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
(一)化学反应调控示例
1.为了灭火,可以采取隔离可燃物、__________或__________等措施。
2.为了延长食物储存时间,可以将其保存在冰箱中。
1.为了灭火,可以采取隔离可燃物、__________或__________等措施。
2.为了延长食物储存时间,可以将其保存在冰箱中。
答案:
隔绝空气 降低温度
(二)工业合成氨条件的控制
1.理论分析工业合成氨的条件选择工业合成氨反应:$N_{2}(g)+3H_{2}(g)\rightleftharpoons 2NH_{3}(g)$ $\Delta H=-92.4\ kJ\cdot mol^{-1}$
(1)反应特点:气体体积减小的放热反应。
(2)增大合成氨的反应速率的条件有__________、__________、__________及__________。
(3)提高平衡混合物中氨的含量的条件有__________、__________、__________。
2.工业合成氨适宜条件的选择
(1)压强:压强越大,对材料的__________和设备的__________就越高,需要的__________也越大,这将会大大增加生产投资,并可能降低综合经济效益。目前,我国的合成氨厂一般采用的压强为__________。
(2)温度:温度降低,合成氨的平衡转化率提高,但反应速率减小。目前,在实际生产中一般采用的温度为__________。
(3)催化剂:通常采用加入催化剂的方法,改变反应历程,降低反应的__________,使反应物在较低温度时能较快地发生反应。目前,合成氨工业中普遍使用的是以铁为主体的多成分催化剂,又称__________。该催化剂在__________左右时的活性最大。为了防止混有的杂质使催化剂“__________”,原料气必须经过净化。
(4)浓度:采取迅速冷却的方法,使气态氨变成液氨后及时从平衡混合物中分离出去,使平衡向生成$NH_{3}$的方向移动。
(5)其他:为了提高$N_{2}$与$H_{2}$的转化率,可以将$NH_{3}$分离后的原料气循环使用。
综合分析:工业上通常采用__________,在$400~500\ ^{\circ}C$和$10\ MPa~30\ MPa$的条件下合成氨。
[微提醒] 实际生产考虑的因素
在实际生产中常常需要结合设备条件、安全操作、经济成本等情况,综合考虑影响化学反应速率和化学平衡的因素,寻找适宜的生产条件。此外,还要考虑环境保护及社会效益等。
答案:
(2)升高温度 增大压强 增大反应物浓度 使用催化剂
(3)降低温度 增大压强 增大反应物浓度
@@
(1)强度 制造要求 动力 10 MPa~30 MPa
(2)400~500 ℃
(3)活化能 铁触媒 500 ℃ 中毒
(5)铁触媒
(2)升高温度 增大压强 增大反应物浓度 使用催化剂
(3)降低温度 增大压强 增大反应物浓度
@@
(1)强度 制造要求 动力 10 MPa~30 MPa
(2)400~500 ℃
(3)活化能 铁触媒 500 ℃ 中毒
(5)铁触媒
1. 为了提高${N2}$和${H2}$的转化率,下列措施正确的是________(填序号)。
①使用铁触媒催化剂 ②增大压强 ③升高温度 ④及时分离出${NH3}$ ⑤通入氖气增大压强
①使用铁触媒催化剂 ②增大压强 ③升高温度 ④及时分离出${NH3}$ ⑤通入氖气增大压强
答案:
②④
2. 在密闭容器中充入$1\ \text{mol}\ {N2}$和$2\ \text{mol}\ {H2}$,在一定条件下达到平衡,容器中剩余$0.5\ \text{mol}\ {N2}$。
(1) 平衡时${N2}$、${H2}$的转化率分别为______、________。
(2) 再充入$0.25\ \text{mol}\ {N2}$,${N2}$的转化率如何变化?____________(填“增大”“减小”或“不变”)。
(1) 平衡时${N2}$、${H2}$的转化率分别为______、________。
(2) 再充入$0.25\ \text{mol}\ {N2}$,${N2}$的转化率如何变化?____________(填“增大”“减小”或“不变”)。
答案:
(1)$50\%$ $75\%$
(2)减小
(1)$50\%$ $75\%$
(2)减小
工业上以黄铁矿(FeS₂)为原料生产硫酸的工艺流程如下图:

A为沸腾炉,A中反应为$4FeS_{2}+11O_{2}\stackrel{高温}{=\!=\!=}2Fe_{2}O_{3}+8SO_{2}$;B为接触室,B中反应为$2SO_{2}(g)+O_{2}(g)\rightleftharpoons 2SO_{3}(g)\ \ \Delta H = - 196.6\ kJ\cdot mol^{-1}$;C为吸收塔,C中反应为$SO_{3}+H_{2}O\rightleftharpoons H_{2}SO_{4}$。接触室中利用催化氧化反应将SO₂转化为SO₃是工业制硫酸中最关键的步骤。
下表是不同压强、温度时SO₂的转化率情况。
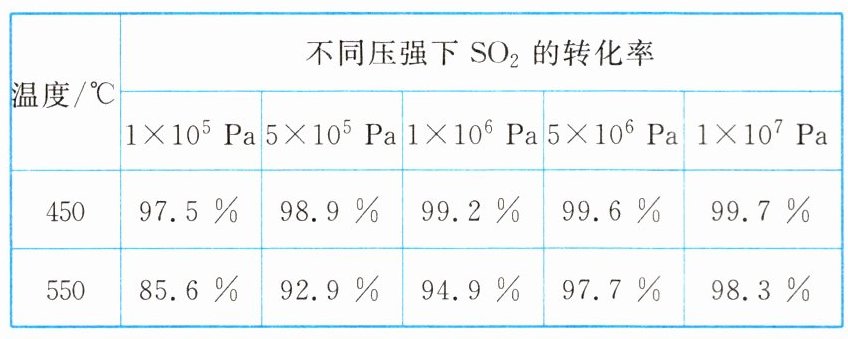
1. 从理论上分析,为了使反应物的转化率尽可能大,在温度和压强方面应如何选择?
2. 在实际工业生产中通常选择的温度是450℃,理由是什么?
3. 在实际工业生产中通常选择的压强是多少?理由是什么?
4. 请解释在合成SO₃的过程中,不需要分离出SO₃的原因。
5. 生产中通入过量空气的目的是什么?

A为沸腾炉,A中反应为$4FeS_{2}+11O_{2}\stackrel{高温}{=\!=\!=}2Fe_{2}O_{3}+8SO_{2}$;B为接触室,B中反应为$2SO_{2}(g)+O_{2}(g)\rightleftharpoons 2SO_{3}(g)\ \ \Delta H = - 196.6\ kJ\cdot mol^{-1}$;C为吸收塔,C中反应为$SO_{3}+H_{2}O\rightleftharpoons H_{2}SO_{4}$。接触室中利用催化氧化反应将SO₂转化为SO₃是工业制硫酸中最关键的步骤。
下表是不同压强、温度时SO₂的转化率情况。

1. 从理论上分析,为了使反应物的转化率尽可能大,在温度和压强方面应如何选择?
2. 在实际工业生产中通常选择的温度是450℃,理由是什么?
3. 在实际工业生产中通常选择的压强是多少?理由是什么?
4. 请解释在合成SO₃的过程中,不需要分离出SO₃的原因。
5. 生产中通入过量空气的目的是什么?
答案:
1. 提示:低温高压。
2. 提示:SO₂转化为SO₃的反应是放热反应,升高温度,反应物转化率降低,在450℃时反应物转化率较高。
3. 提示:1×10⁵ Pa。常压下SO₂的转化率已经很高,若采用较大的压强,SO₂的转化率提高很少,但对设备及动力的要求更高。
4. 提示:SO₂的转化率比较高,达到平衡后的混合气体中SO₂的余量很少,故不需要分离出SO₃。
5. 提示:增大O₂浓度,提高SO₂的转化率。
2. 提示:SO₂转化为SO₃的反应是放热反应,升高温度,反应物转化率降低,在450℃时反应物转化率较高。
3. 提示:1×10⁵ Pa。常压下SO₂的转化率已经很高,若采用较大的压强,SO₂的转化率提高很少,但对设备及动力的要求更高。
4. 提示:SO₂的转化率比较高,达到平衡后的混合气体中SO₂的余量很少,故不需要分离出SO₃。
5. 提示:增大O₂浓度,提高SO₂的转化率。
1. 纳米钴常作为CO加氢反应的催化剂:$CO(g)+3H_{2}(g)\rightleftharpoons CH_{4}(g)+H_{2}O(g)\ \ \Delta H<0$。下列说法正确的是( )
A. 纳米技术的应用,优化了催化剂的性能,提高了反应的转化率
B. 缩小容器容积,平衡向正反应方向移动,CO的浓度增大
C. 从平衡体系中分离出H₂O(g)能加快正反应速率
D. 工业生产中采用高温条件,其目的是提高CO的平衡转化率
A. 纳米技术的应用,优化了催化剂的性能,提高了反应的转化率
B. 缩小容器容积,平衡向正反应方向移动,CO的浓度增大
C. 从平衡体系中分离出H₂O(g)能加快正反应速率
D. 工业生产中采用高温条件,其目的是提高CO的平衡转化率
答案:
B 催化剂可加快反应速率,但不能使平衡发生移动,A错误;该反应的正反应是气体体积减小的反应,缩小容器的容积,平衡向正反应方向移动,但CO的浓度增大,B正确;从平衡体系中分离出H₂O(g),达到新的平衡,正、逆反应速率比原平衡慢,C错误;该反应的正反应为放热反应,升高温度,平衡逆向移动,反应物转化率会降低,工业生产中采用高温条件,能提高化学反应速率,缩短达到平衡所需要的时间,D错误。
2. 在某刚性容器中发生$CH_{2}=CH_{2}(g)+H_{2}O(g)\rightleftharpoons CH_{3}CH_{2}OH(g)\ \ \Delta H<0$,下列说法正确的是( )
A. 恒温恒容条件下,增大$n[CH_{2}=CH_{2}(g)]:n[H_{2}O(g)]$,则$CH_{2}=CH_{2}(g)$的平衡转化率增大
B. 恒温恒压条件下达到平衡状态,再通入适量氮气,平衡逆向移动,平衡常数减小
C. 恒温恒容条件下达到平衡状态,升高温度,$v_{正}$增大,$v_{逆}$增大,平衡向逆反应方向移动
D. 加入催化剂,能缩短达到平衡的时间,并提高$CH_{3}CH_{2}OH(g)$的平衡产率
A. 恒温恒容条件下,增大$n[CH_{2}=CH_{2}(g)]:n[H_{2}O(g)]$,则$CH_{2}=CH_{2}(g)$的平衡转化率增大
B. 恒温恒压条件下达到平衡状态,再通入适量氮气,平衡逆向移动,平衡常数减小
C. 恒温恒容条件下达到平衡状态,升高温度,$v_{正}$增大,$v_{逆}$增大,平衡向逆反应方向移动
D. 加入催化剂,能缩短达到平衡的时间,并提高$CH_{3}CH_{2}OH(g)$的平衡产率
答案:
C 恒温恒容条件下,增大n[CH₂=CH₂(g)]:n[H₂O(g)],则CH₂=CH₂(g)的平衡转化率减小,A错误;该恒温恒压条件下达到平衡状态,再通入适量氦气,平衡逆向移动,平衡常数不变,B错误;该反应为放热反应,恒温恒容条件下达到平衡状态,升高温度,v正和v逆均增大,平衡向逆反应方向移动,C正确;加入催化剂,能缩短达到平衡的时间,但不能提高CH₃CH₂OH(g)的平衡产率,D错误。
[典例1] 对于反应$2A(g)+B(g)\rightleftharpoons 2C(g)\ \ \Delta H<0$,下列图像正确的是( )


答案:
D 该反应的特点是气体物质分子数目减小的放热反应,增大压强,平衡向正反应方向移动,A的转化率增大,B的含量减小,C的物质的量分数增大;升高温度,平衡向逆反应方向移动,A的转化率减小,B的物质的量分数增大,C的物质的量分数减小,达到平衡的时间变短。故D正确。
[典例2] 在2 L恒容密闭容器中充入2 mol X和1 mol Y,发生反应$2X(g)+Y(g)\rightleftharpoons 3Z(g)$,反应过程持续升高温度,测得X的体积分数与温度的关系如右图所示。下列推断正确的是( )


A.Q点时,Y的转化率最大
B.升高温度,平衡常数增大
C.W点X的正反应速率等于M点X的正反应速率
D.平衡时,再充入Y,达到平衡时Z的体积分数一定增大
答案:
A 根据题给图像可知,升高温度,平衡向逆反应方向移动,ΔH<0,K减小;W点与M点温度不同,速率不同;其他条件一定时,反应物的物质的量之比符合化学计量数之比时,产物的百分含量最大。
1. 对于可逆反应$2AB_{3}(g)\rightleftharpoons 2A(g)+3B_{2}(g)\ \ \Delta H>0$,下列图像不正确的是( )


答案:
D 随着温度升高,正反应速率和逆反应速率均增大,而反应的ΔH>0,升高温度,平衡正向移动,故达平衡,即v正 = v逆后,v正增速比v逆快,A项正确;因ΔH>0,温度越高,反应速率越快,越先达到平衡状态,AB₃的转化率越大,混合气体中AB₃的体积分数越小,B项正确;该反应为气体体积增大的反应,故增大压强,平衡逆向移动,混合气体中AB₃的体积分数增大,因ΔH>0,升高温度,平衡正向移动,混合气体中AB₃的体积分数减小,C项正确;由以上分析可知,压强越大,AB₃的转化率越小,温度越高,AB₃的转化率越大,D项错误。
2.(2024·山东卷改编)逆水煤气变换反应:$CO_{2}(g)+H_{2}(g)\rightleftharpoons CO(g)+H_{2}O(g)\ \ \Delta H>0$。一定压力下,按$CO_{2}$、$H_{2}$物质的量之比$n(CO_{2}):n(H_{2}) = 1:1$投料,$T_{1}$、$T_{2}$温度时反应物摩尔分数随时间变化关系如图所示。已知该反应的速率方程为$v = kc^{0.5}(H_{2})c(CO_{2})$,$T_{1}$、$T_{2}$温度时反应速率常数k分别为$k_{1}$、$k_{2}$。下列说法正确的是( )

A. $k_{1}<k_{2}$
B. $T_{1}$、$T_{2}$温度下达平衡时反应速率的比值:$\frac{v(T_{1})}{v(T_{2})}<\frac{k_{1}}{k_{2}}$
C. 温度不变,仅改变体系初始压力,反应物摩尔分数随时间的变化曲线不变
D. $T_{2}$温度下,改变初始投料比例,可使平衡时各组分摩尔分数与$T_{1}$温度时相同

A. $k_{1}<k_{2}$
B. $T_{1}$、$T_{2}$温度下达平衡时反应速率的比值:$\frac{v(T_{1})}{v(T_{2})}<\frac{k_{1}}{k_{2}}$
C. 温度不变,仅改变体系初始压力,反应物摩尔分数随时间的变化曲线不变
D. $T_{2}$温度下,改变初始投料比例,可使平衡时各组分摩尔分数与$T_{1}$温度时相同
答案:
B 由图可知,T₁比T₂反应速率快,则T₁>T₂;T₁温度下达到平衡时反应物的摩尔分数低于T₂温度下平衡时;由于起始CO₂与H₂的物质的量之比为1:1,则达到平衡时CO₂和H₂的摩尔分数相等。根据分析,T₁比T₂反应速率快,反应速率常数与温度有关,结合反应速率方程知k₁>k₂,A项错误。已知反应的速率方程v = kc⁰.⁵(H₂)c(CO₂),则$\frac{v(T₁)}{v(T₂)}=\frac{k₁c₁⁰.⁵(H₂)c₁(CO₂)}{k₂c₂⁰.⁵(H₂)c₂(CO₂)}$,T₁温度下达到平衡时反应物的摩尔分数低于T₂温度下平衡时,则$\frac{v(T₁)}{v(T₂)}<\frac{k₁}{k₂}$,B项正确。温度不变,仅改变体系初始压力,虽然平衡不移动,但反应物的浓度改变,反应速率改变,反应达到平衡的时间改变,反应物摩尔分数随时间的变化曲线变化,C项错误。T₂温度下,改变初始投料比,相当于改变某一反应物的浓度,达到平衡时H₂和CO₂的摩尔分数不可能相等,故不能使平衡时各组分摩尔分数与T₁温度时相同,D项错误。
3. 在三个体积相同的密闭容器中加入相同物质的量的CO和H₂O,在不同温度下发生反应$CO(g)+H_{2}O(l)\rightleftharpoons CO_{2}(g)+H_{2}(g)\ \ \Delta H<0$,经过相同时间后测得容器中CO的物质的量与温度的关系如上图所示。

(1)A、C两点的速率大小:$v(A)$____(填“大于”“小于”“等于”或“无法判断”)$v(C)$。
(2)请解释曲线中CO的物质的量先减小后增大的原因:____。

(1)A、C两点的速率大小:$v(A)$____(填“大于”“小于”“等于”或“无法判断”)$v(C)$。
(2)请解释曲线中CO的物质的量先减小后增大的原因:____。
答案:
解析:
(1)C点温度高于A点,则A、C两点的速率大小:v(A)小于v(C)。
(2)曲线中CO的物质的量先减小后增大,其原因是反应开始时,因温度较低,反应速率较慢,故反应未达到平衡,温度越高,化学反应速率越快,在相同时间内CO消耗量随温度升高而增大,故CO的物质的量逐渐减小,到最小值时反应达到平衡;后一阶段,由于温度较高,化学反应速率较快,在相同的时间内反应已达平衡,由于反应是放热反应,温度升高平衡逆向移动,故CO的物质的量又逐渐增大。
答案:
(1)小于
(2)前一阶段,反应未达到平衡,温度越高,化学反应速率越快,在相同时间内CO消耗量随温度升高而增大;后一阶段,反应已达平衡,由于反应是放热反应,温度升高平衡逆向移动,CO的量增大
(1)C点温度高于A点,则A、C两点的速率大小:v(A)小于v(C)。
(2)曲线中CO的物质的量先减小后增大,其原因是反应开始时,因温度较低,反应速率较慢,故反应未达到平衡,温度越高,化学反应速率越快,在相同时间内CO消耗量随温度升高而增大,故CO的物质的量逐渐减小,到最小值时反应达到平衡;后一阶段,由于温度较高,化学反应速率较快,在相同的时间内反应已达平衡,由于反应是放热反应,温度升高平衡逆向移动,故CO的物质的量又逐渐增大。
答案:
(1)小于
(2)前一阶段,反应未达到平衡,温度越高,化学反应速率越快,在相同时间内CO消耗量随温度升高而增大;后一阶段,反应已达平衡,由于反应是放热反应,温度升高平衡逆向移动,CO的量增大
查看更多完整答案,请扫码查看


