2025年新课程学习指导高中化学选择性必修1人教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年新课程学习指导高中化学选择性必修1人教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第50页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
酸雨是pH小于5.6的降水。左图为酸雨的形成过程,那么,酸雨中有些溶质?这些溶质在水中是以什么形式存在的?
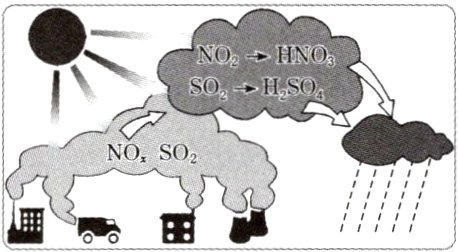

答案:
略。
(一)强电解质和弱电解质
1. 电解质
在水溶液里或熔融状态下能够导电的化合物。
2. 强电解质和弱电解质
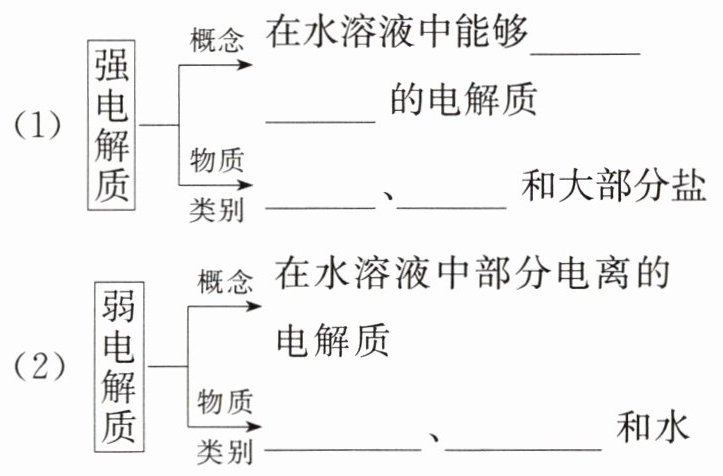
[微提醒] 在强电解质溶液中除H₂O分子外,只有阴、阳离子;在弱电解质溶液中除H₂O分子外,还有溶质分子和阴、阳离子。
3. 强弱电解质示例分析
(1) 相同物质的量浓度的盐酸和醋酸的导电能力,前者______。
(2) 盐酸溶液中,HCl______电离生成H⁺和Cl⁻;CH₃COOH溶液中,CH₃COOH______电离生成CH₃COO⁻和H⁺。
[微拓展] 弱电解质的电离一般是吸热的,极少数电离是放热的,如HF(aq)⇌H⁺(aq)+F⁻(aq) ΔH<0。
1. 电解质
在水溶液里或熔融状态下能够导电的化合物。
2. 强电解质和弱电解质

[微提醒] 在强电解质溶液中除H₂O分子外,只有阴、阳离子;在弱电解质溶液中除H₂O分子外,还有溶质分子和阴、阳离子。
3. 强弱电解质示例分析
(1) 相同物质的量浓度的盐酸和醋酸的导电能力,前者______。
(2) 盐酸溶液中,HCl______电离生成H⁺和Cl⁻;CH₃COOH溶液中,CH₃COOH______电离生成CH₃COO⁻和H⁺。
[微拓展] 弱电解质的电离一般是吸热的,极少数电离是放热的,如HF(aq)⇌H⁺(aq)+F⁻(aq) ΔH<0。
答案:
(1)全部电离 强酸 强碱
(2)弱酸 弱碱
@@
(1)较强
(2)全部 部分
(1)全部电离 强酸 强碱
(2)弱酸 弱碱
@@
(1)较强
(2)全部 部分
(二)弱电解质的电离平衡
1. 弱电解质的电离方程式
CH₃COOH、NH₃·H₂O的电离方程式分别为______、______。
2. 弱电解质的电离平衡(以CH₃COOH的电离平衡为例)
在电离初始,c(CH₃COOH)逐渐减小,v(电离)逐渐______,c(CH₃COO⁻)与c(H⁺)逐渐增大,v(结合)逐渐______。当各离子浓度不再改变、v(电离)______v(结合)≠0时,电离达到平衡状态。故在一定条件下(如温度和浓度),弱电解质电离成离子的速率和离子结合成分子的速率______时,电离过程达到平衡状态。
3. 影响电离平衡的因素
与其他化学平衡一样,当______、______等条件改变时,电离平衡会发生移动。例如,在氨水中加入NH₄Cl,NH₄Cl在溶液中完全电离,于是溶液中NH₄⁺的浓度增大,使NH₃·H₂O的电离平衡向______移动。
[微规律] 弱电解质溶液越稀,弱电解质的电离程度越大。
1. 弱电解质的电离方程式
CH₃COOH、NH₃·H₂O的电离方程式分别为______、______。
2. 弱电解质的电离平衡(以CH₃COOH的电离平衡为例)
在电离初始,c(CH₃COOH)逐渐减小,v(电离)逐渐______,c(CH₃COO⁻)与c(H⁺)逐渐增大,v(结合)逐渐______。当各离子浓度不再改变、v(电离)______v(结合)≠0时,电离达到平衡状态。故在一定条件下(如温度和浓度),弱电解质电离成离子的速率和离子结合成分子的速率______时,电离过程达到平衡状态。
3. 影响电离平衡的因素
与其他化学平衡一样,当______、______等条件改变时,电离平衡会发生移动。例如,在氨水中加入NH₄Cl,NH₄Cl在溶液中完全电离,于是溶液中NH₄⁺的浓度增大,使NH₃·H₂O的电离平衡向______移动。
[微规律] 弱电解质溶液越稀,弱电解质的电离程度越大。
答案:
$CH_{3}\xrightleftharpoons[]{}CH_{3}COO^{-} + H^{+}$
$NH_{3}\cdot H_{2}O\xrightleftharpoons[]{}NH^{+}_{4} + OH^{-}$
@@减小 增大 = 相等
@@浓度 温度 左
$NH_{3}\cdot H_{2}O\xrightleftharpoons[]{}NH^{+}_{4} + OH^{-}$
@@减小 增大 = 相等
@@浓度 温度 左
查看更多完整答案,请扫码查看


