2025年新课程学习指导高中化学选择性必修1人教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年新课程学习指导高中化学选择性必修1人教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第37页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
2.在一定温度下,1L的密闭容器中发生反应$C(s) + H_{2}O(g)\xrightleftharpoons[]{}CO(g) + H_{2}(g)$,平衡时测得C、${H_{2}O}$、CO、${H_{2}}$的物质的量都为0.1 mol。
(1)该反应的平衡常数$K =$______。(2)该温度下,再充入0.1 mol ${H_{2}O(g)}$和0.2 mol ${H_{2}(g)}$,平衡向______方向移动。
(1)该反应的平衡常数$K =$______。(2)该温度下,再充入0.1 mol ${H_{2}O(g)}$和0.2 mol ${H_{2}(g)}$,平衡向______方向移动。
答案:
(1)0.1
(2)逆反应
(1)0.1
(2)逆反应
3.某温度下,${N_{2}O_{5}}$气体在一体积固定的容器中发生如下反应:${2N_{2}O_{5}(g)\xlongequal{}4NO_{2}(g) + O_{2}(g)}$(慢反应) $\Delta H<0$,$2NO_{2}(g)\xrightleftharpoons[]{} N_{2}O_{4}(g)$(快反应) $\Delta H<0$。体系的总压强$p_{总}$和$p({O_{2}})$随时间的变化如右图所示。
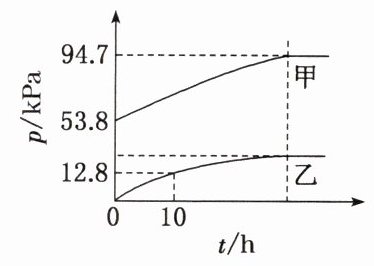
(1)图中表示${O_{2}}$压强变化的曲线是______(填“甲”或“乙”)。
(2)已知${N_{2}O_{5}}$分解的反应速率$v = 0.12p({N_{2}O_{5}})\ kPa·h^{-1}$,$t = 10\ h$时,$p({N_{2}O_{5}})=$______kPa,$v =$______$kPa·h^{-1}$(结果保留两位小数)。
(3)该温度下$2NO_{2}(g)\xrightleftharpoons[]{} N_{2}O_{4}(g)$反应的平衡常数$K_{p}=$______($K_{p}$为以分压表示的平衡常数,结果保留两位小数)。

(1)图中表示${O_{2}}$压强变化的曲线是______(填“甲”或“乙”)。
(2)已知${N_{2}O_{5}}$分解的反应速率$v = 0.12p({N_{2}O_{5}})\ kPa·h^{-1}$,$t = 10\ h$时,$p({N_{2}O_{5}})=$______kPa,$v =$______$kPa·h^{-1}$(结果保留两位小数)。
(3)该温度下$2NO_{2}(g)\xrightleftharpoons[]{} N_{2}O_{4}(g)$反应的平衡常数$K_{p}=$______($K_{p}$为以分压表示的平衡常数,结果保留两位小数)。
答案:
(1)乙
(2)28.2 3.38
(3)0.05
(1)乙
(2)28.2 3.38
(3)0.05
1.(2023·北京卷)下列事实能用平衡移动原理解释的是( )
A. $H_{2}O_{2}$溶液中加入少量$MnO_{2}$固体,促进$H_{2}O_{2}$分解
B. 密闭烧瓶内的$NO_{2}$和$N_{2}O_{4}$的混合气体,受热后颜色加深
C. 铁钉放入浓$HNO_{3}$中,待不再变化后,加热能产生大量红棕色气体
D. 锌片与稀$H_{2}SO_{4}$反应过程中,加入少量$CuSO_{4}$固体,促进$H_{2}$的产生
A. $H_{2}O_{2}$溶液中加入少量$MnO_{2}$固体,促进$H_{2}O_{2}$分解
B. 密闭烧瓶内的$NO_{2}$和$N_{2}O_{4}$的混合气体,受热后颜色加深
C. 铁钉放入浓$HNO_{3}$中,待不再变化后,加热能产生大量红棕色气体
D. 锌片与稀$H_{2}SO_{4}$反应过程中,加入少量$CuSO_{4}$固体,促进$H_{2}$的产生
答案:
B
2. 高温下,某反应达到平衡,平衡常数$K = \frac{c(CO)\cdot c(H_{2}O)}{c(CO_{2})\cdot c(H_{2})}$。恒容时,温度升高,$H_{2}$浓度减小。下列说法正确的是( )
A. 恒温恒压时充入惰性气体,$H_{2}$浓度一定不变
B. 该反应的焓变为正值
C. 升高温度,逆反应速率减小
D. 该反应化学方程式为$CO + H_{2}O\underset{高温}{\overset{催化剂}{\rightleftharpoons}}CO_{2} + H_{2}$
A. 恒温恒压时充入惰性气体,$H_{2}$浓度一定不变
B. 该反应的焓变为正值
C. 升高温度,逆反应速率减小
D. 该反应化学方程式为$CO + H_{2}O\underset{高温}{\overset{催化剂}{\rightleftharpoons}}CO_{2} + H_{2}$
答案:
B
3. 有可逆反应:$A(g) + 3B(g)\rightleftharpoons 2C(g)$ $\Delta H<0$。
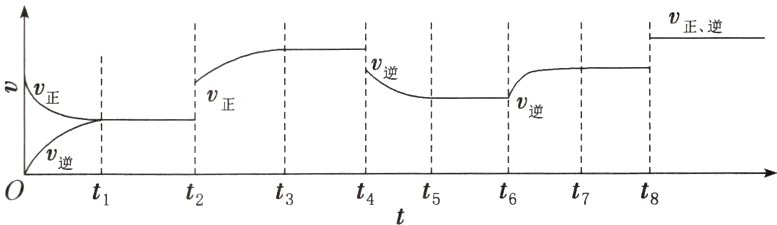
已知在$t_{1}$、$t_{3}$、$t_{5}$、$t_{7}$时反应都达到平衡,如果$t_{2}$、$t_{4}$、$t_{6}$、$t_{8}$时都只改变了一个反应条件,则下列对$t_{2}$、$t_{4}$、$t_{6}$、$t_{8}$时改变条件的判断正确的是( )
A. 降低温度、增大压强、减小反应物浓度、使用催化剂
B. 使用催化剂、增大压强、增大反应物浓度、升高温度
C. 增大反应物浓度、使用催化剂、减小压强、升高温度
D. 升高温度、减小压强、增大反应物浓度、使用催化剂

已知在$t_{1}$、$t_{3}$、$t_{5}$、$t_{7}$时反应都达到平衡,如果$t_{2}$、$t_{4}$、$t_{6}$、$t_{8}$时都只改变了一个反应条件,则下列对$t_{2}$、$t_{4}$、$t_{6}$、$t_{8}$时改变条件的判断正确的是( )
A. 降低温度、增大压强、减小反应物浓度、使用催化剂
B. 使用催化剂、增大压强、增大反应物浓度、升高温度
C. 增大反应物浓度、使用催化剂、减小压强、升高温度
D. 升高温度、减小压强、增大反应物浓度、使用催化剂
答案:
D
4. 氮元素的单质及其化合物在农业生产、生活、国防和科技方面都有着重要作用,但一些氮的化合物又会对环境造成污染。因此,如何利用氮及氮的化合物是科研人员的重要研究课题。
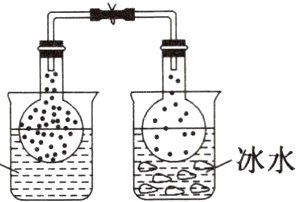
已知:$N_{2}O_{4}$(无色)$\rightleftharpoons 2NO_{2}$(红棕色)。请回答下列有关问题:
(1)将两只烧瓶分别浸泡在热水和冰水中,如由图中现象说明该反应为________(填“放热”或“吸热”)反应。
(2)在容积为$2\ L$的容器中,通入一定量的$N_{2}O_{4}$,$100\ ^{\circ}C$时,体系中各物质的浓度随时间变化如下表:
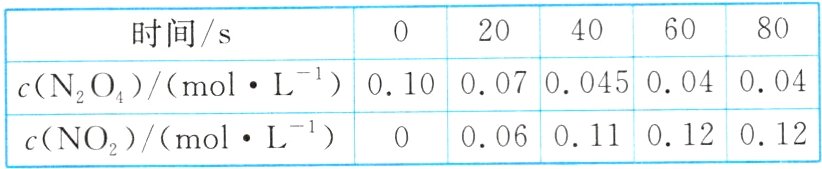
①在$0~20\ s$时段,反应速率$v(NO_{2}) =$______。
②在该温度下,$N_{2}O_{4}(g)\rightleftharpoons 2NO_{2}(g)$的平衡常数$K =$__________。
③改变条件重新达到平衡时,要使$\frac{c(NO_{2})}{c(N_{2}O_{4})}$的值变小,可采取的措施有________(填字母)。
A. 升高温度
B. 增大$N_{2}O_{4}$的起始浓度
C. 使用合适的催化剂
D. 缩小体积
已知:$N_{2}O_{4}$(无色)$\rightleftharpoons 2NO_{2}$(红棕色)。请回答下列有关问题:
(1)将两只烧瓶分别浸泡在热水和冰水中,如由图中现象说明该反应为________(填“放热”或“吸热”)反应。

(2)在容积为$2\ L$的容器中,通入一定量的$N_{2}O_{4}$,$100\ ^{\circ}C$时,体系中各物质的浓度随时间变化如下表:

①在$0~20\ s$时段,反应速率$v(NO_{2}) =$______。
②在该温度下,$N_{2}O_{4}(g)\rightleftharpoons 2NO_{2}(g)$的平衡常数$K =$__________。
③改变条件重新达到平衡时,要使$\frac{c(NO_{2})}{c(N_{2}O_{4})}$的值变小,可采取的措施有________(填字母)。
A. 升高温度
B. 增大$N_{2}O_{4}$的起始浓度
C. 使用合适的催化剂
D. 缩小体积
答案:
解析:
(1)将两只烧瓶分别放入热水与冰水中,看到热水中气体颜色加深,冰水中气体颜色变浅,说明升高温度化学平衡正向移动,该反应的正反应是吸热反应。
(2)①根据表格数据可知:在0~20 s时段,$\Delta c(NO_{2}) = 0.06\ mol\cdot L^{-1}$,则用$NO_{2}$的浓度变化表示的化学反应速率$v(NO_{2})=\frac{0.06\ mol\cdot L^{-1}}{20\ s}=0.003\ mol\cdot L^{-1}\cdot s^{-1}$。②当反应达到平衡时$c(N_{2}O_{4}) = 0.04\ mol\cdot L^{-1}$,$c(NO_{2}) = 0.12\ mol\cdot L^{-1}$,则该反应的化学平衡常数$K=\frac{c^{2}(NO_{2})}{c(N_{2}O_{4})}=\frac{0.12^{2}}{0.04}=0.36$。③该反应的正反应是吸热反应,升高温度化学平衡正向移动,导致$\frac{c(NO_{2})}{c(N_{2}O_{4})}$的值增大,A不符合题意;使用合适的催化剂化学平衡不发生移动,$\frac{c(NO_{2})}{c(N_{2}O_{4})}$的值不变,C不符合题意;增大$N_{2}O_{4}$起始浓度,相当于增大压强,缩小体积也会导致体系的压强增大,增大压强,化学平衡向气体体积减小的逆反应方向移动,最终达到平衡时$\frac{c(NO_{2})}{c(N_{2}O_{4})}$的值减小,B、D符合题意。
答案:
(1)吸热
(2)①$0.003\ mol\cdot L^{-1}\cdot s^{-1}$ ②0.36 ③BD
(1)将两只烧瓶分别放入热水与冰水中,看到热水中气体颜色加深,冰水中气体颜色变浅,说明升高温度化学平衡正向移动,该反应的正反应是吸热反应。
(2)①根据表格数据可知:在0~20 s时段,$\Delta c(NO_{2}) = 0.06\ mol\cdot L^{-1}$,则用$NO_{2}$的浓度变化表示的化学反应速率$v(NO_{2})=\frac{0.06\ mol\cdot L^{-1}}{20\ s}=0.003\ mol\cdot L^{-1}\cdot s^{-1}$。②当反应达到平衡时$c(N_{2}O_{4}) = 0.04\ mol\cdot L^{-1}$,$c(NO_{2}) = 0.12\ mol\cdot L^{-1}$,则该反应的化学平衡常数$K=\frac{c^{2}(NO_{2})}{c(N_{2}O_{4})}=\frac{0.12^{2}}{0.04}=0.36$。③该反应的正反应是吸热反应,升高温度化学平衡正向移动,导致$\frac{c(NO_{2})}{c(N_{2}O_{4})}$的值增大,A不符合题意;使用合适的催化剂化学平衡不发生移动,$\frac{c(NO_{2})}{c(N_{2}O_{4})}$的值不变,C不符合题意;增大$N_{2}O_{4}$起始浓度,相当于增大压强,缩小体积也会导致体系的压强增大,增大压强,化学平衡向气体体积减小的逆反应方向移动,最终达到平衡时$\frac{c(NO_{2})}{c(N_{2}O_{4})}$的值减小,B、D符合题意。
答案:
(1)吸热
(2)①$0.003\ mol\cdot L^{-1}\cdot s^{-1}$ ②0.36 ③BD
城市中的汽车,每天会产生大量的尾气,其中的NO、CO是重要污染物。反应${2NO + 2CO \xlongequal{} N_2 + 2CO_2}$在一定条件下能自发进行吗?


答案:
略。
查看更多完整答案,请扫码查看


