2025年新课程学习指导高中化学选择性必修1人教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年新课程学习指导高中化学选择性必修1人教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第21页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
1. 在C(s)+CO₂(g)$\xrightleftharpoons[]{}$2CO(g)的反应中,现采取下列措施:
①缩小体积,增大压强 ②增加C的量 ③通入CO₂ ④恒容下充入N₂ ⑤恒压下充入N₂
其中能够使反应速率增大的措施是( )
A. ①④
B. ②③⑤
C. ①③
D. ①②④
①缩小体积,增大压强 ②增加C的量 ③通入CO₂ ④恒容下充入N₂ ⑤恒压下充入N₂
其中能够使反应速率增大的措施是( )
A. ①④
B. ②③⑤
C. ①③
D. ①②④
答案:
C
2. 为比较Fe³⁺和Cu²⁺对H₂O₂分解反应的催化效果,两位同学分别设计了如图甲、乙所示的实验。下列叙述中不正确的是( )
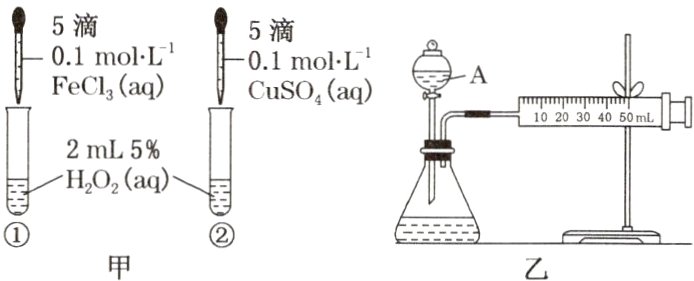
A. 图甲所示实验可通过观察产生气泡的快慢来比较反应速率的大小
B. 若图甲所示实验中反应速率为①>②,则一定说明Fe³⁺比Cu²⁺对H₂O₂分解催化效果好
C. 用图乙所示装置测定反应速率,可测定反应产生的气体体积及反应时间
D. 为检查图乙所示装置的气密性,可关闭A的活塞,将注射器活塞拉出一定距离,一段时间后松开活塞,观察活塞是否回到原位

A. 图甲所示实验可通过观察产生气泡的快慢来比较反应速率的大小
B. 若图甲所示实验中反应速率为①>②,则一定说明Fe³⁺比Cu²⁺对H₂O₂分解催化效果好
C. 用图乙所示装置测定反应速率,可测定反应产生的气体体积及反应时间
D. 为检查图乙所示装置的气密性,可关闭A的活塞,将注射器活塞拉出一定距离,一段时间后松开活塞,观察活塞是否回到原位
答案:
B
3. 为探究反应物浓度对化学反应速率的影响,设计的实验方案如下表所示:

表中Vₓ = ________ mL,理由是________________________。

表中Vₓ = ________ mL,理由是________________________。
答案:
2.0 保证反应物$K_{2}S_{2}O_{8}$的浓度改变,而其他物质浓度不变
1. “液态阳光”能有效助力我国实现碳达峰和碳中和,其主要反应之一是$CO_{2}(g)+3H_{2}(g)=CH_{3}OH(g)+H_{2}O(g)$(放热反应)。下列有关说法正确的是 ( )
A. 升高温度能加快反应速率
B. 减小$H_{2}$浓度能加快反应速率
C. 反应物的总能量低于生成物的总能量
D. 使用催化剂不影响反应速率,能影响反应限度
A. 升高温度能加快反应速率
B. 减小$H_{2}$浓度能加快反应速率
C. 反应物的总能量低于生成物的总能量
D. 使用催化剂不影响反应速率,能影响反应限度
答案:
A
2. 我国科学家利用$Pt/α - MoC$催化剂实现氢气的低温制备和存储,涉及的化学反应为$CH_{3}OH(g)+H_{2}O(g)\stackrel{催化剂}{=}3H_{2}(g)+CO_{2}(g)$。不同反应条件下测得反应速率如下,反应速率最大的是 ( )
A. $v(H_{2}O)=0.10\ mol\cdot L^{-1}\cdot min^{-1}$
B. $v(H_{2})=0.27\ mol\cdot L^{-1}\cdot min^{-1}$
C. $v(CH_{3}OH)=0.01\ mol\cdot L^{-1}\cdot s^{-1}$
D. $v(CO_{2})=2.0\ mol\cdot L^{-1}\cdot h^{-1}$
A. $v(H_{2}O)=0.10\ mol\cdot L^{-1}\cdot min^{-1}$
B. $v(H_{2})=0.27\ mol\cdot L^{-1}\cdot min^{-1}$
C. $v(CH_{3}OH)=0.01\ mol\cdot L^{-1}\cdot s^{-1}$
D. $v(CO_{2})=2.0\ mol\cdot L^{-1}\cdot h^{-1}$
答案:
C
3. $T\ ^{\circ}C$时,在$0.5\ L$的密闭容器中,气体$A$与气体$B$反应生成气体$C$,反应过程中$A$、$B$、$C$的浓度变化如右图所示。
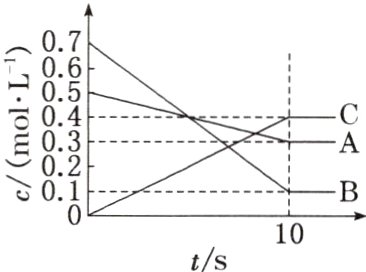
下列结论正确的是 ( )
A. $10\ s$时反应生成了$0.4\ mol\ C$
B. 该反应进行到$10\ s$时,消耗了$0.1\ mol\ A$
C. 该反应的化学方程式为$3A + B = 2C$
D. $10\ s$内用$B$表示的反应速率为$0.01\ mol\cdot L^{-1}\cdot s^{-1}$

下列结论正确的是 ( )
A. $10\ s$时反应生成了$0.4\ mol\ C$
B. 该反应进行到$10\ s$时,消耗了$0.1\ mol\ A$
C. 该反应的化学方程式为$3A + B = 2C$
D. $10\ s$内用$B$表示的反应速率为$0.01\ mol\cdot L^{-1}\cdot s^{-1}$
答案:
B
4. 某同学利用如下图所示装置测定化学反应速率。(已知:$S_{2}O_{3}^{2 - } + 2H^{+} = H_{2}O + S\downarrow + SO_{2}\uparrow$)
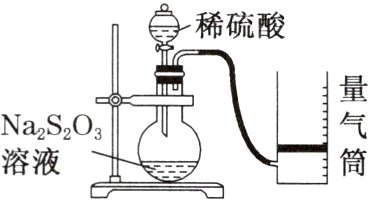
(1)为保证实验的准确性、可靠性,利用该装置进行实验前应先进行的步骤是______________;除图中实验用品、仪器外,还需要的一种实验仪器是______________。
(2)若在$2\ min$时收集到$224\ mL$(已折算成标准状况)气体,可计算出这$2\ min$内$H^{+}$的反应速率,但该测定值比实际值偏小,其原因是______________________________。
(3)试简述测定该反应的反应速率的其他方法:______________________________(写一种即可)。

(1)为保证实验的准确性、可靠性,利用该装置进行实验前应先进行的步骤是______________;除图中实验用品、仪器外,还需要的一种实验仪器是______________。
(2)若在$2\ min$时收集到$224\ mL$(已折算成标准状况)气体,可计算出这$2\ min$内$H^{+}$的反应速率,但该测定值比实际值偏小,其原因是______________________________。
(3)试简述测定该反应的反应速率的其他方法:______________________________(写一种即可)。
答案:
(1)检查装置的气密性 秒表
(2)部分$SO_{2}$溶于水,使测得气体体积偏小
(3)测定一定时间内生成硫单质的质量(或$H^{+}$浓度的变化)(其他合理答案均可)
(1)检查装置的气密性 秒表
(2)部分$SO_{2}$溶于水,使测得气体体积偏小
(3)测定一定时间内生成硫单质的质量(或$H^{+}$浓度的变化)(其他合理答案均可)
催化剂可以改变反应历程,降低反应所需的能量,使反应变得更容易。那么催化剂改变反应速率的原因是什么?

答案:
略。
(一)活化能与有效碰撞
1. 基元反应
大多数化学反应并不是经过简单碰撞就能完成的,而往往经过多个反应步骤才能实现,每一步反应都称为______反应,基元反应反映了反应______。反应历程又称反应______。如$2HI = H_{2}+I_{2}$实际上是经过下面两步基元反应完成的:$2HI→H_{2}+2I·$,__________。
2. 有效碰撞
(1)反应物分子间的碰撞$\begin{cases}能够发生化学反应的碰撞→\_\_\_\_\_\\不能发生化学反应的碰撞→无效碰撞\end{cases}$
(2)有效碰撞必须具有的条件:一是反应物分子具有一定的______,二是碰撞时有合适的______。
3. 活化分子
发生____________的分子必须具有足够的能量,这种分子叫做活化分子。
4. 活化能
(1)定义:______具有的平均能量与______具有的平均能量之差。
(2)图解:
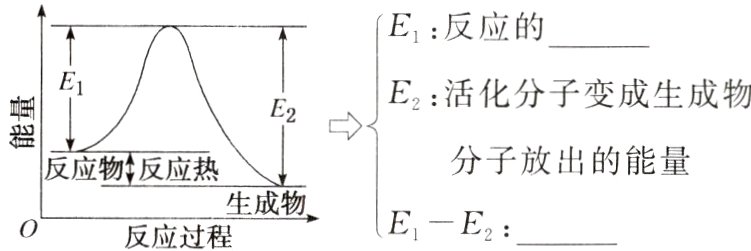
[微提醒] 活化能与反应速率的关系
反应的活化能越小,反应速率越大,该反应越易发生。若活化能为0,反应瞬间可以完成,如中和反应、沉淀反应的活化能几乎为0。
1. 基元反应
大多数化学反应并不是经过简单碰撞就能完成的,而往往经过多个反应步骤才能实现,每一步反应都称为______反应,基元反应反映了反应______。反应历程又称反应______。如$2HI = H_{2}+I_{2}$实际上是经过下面两步基元反应完成的:$2HI→H_{2}+2I·$,__________。
2. 有效碰撞
(1)反应物分子间的碰撞$\begin{cases}能够发生化学反应的碰撞→\_\_\_\_\_\\不能发生化学反应的碰撞→无效碰撞\end{cases}$
(2)有效碰撞必须具有的条件:一是反应物分子具有一定的______,二是碰撞时有合适的______。
3. 活化分子
发生____________的分子必须具有足够的能量,这种分子叫做活化分子。
4. 活化能
(1)定义:______具有的平均能量与______具有的平均能量之差。
(2)图解:

[微提醒] 活化能与反应速率的关系
反应的活化能越小,反应速率越大,该反应越易发生。若活化能为0,反应瞬间可以完成,如中和反应、沉淀反应的活化能几乎为0。
答案:
基元 历程 机理 $2I\cdot\rightarrow I_{2}$
@@
(1)有效碰撞
(2)能量 取向
@@有效碰撞
@@
(1)活化分子 反应物分子
(2)活化能 反应热
@@
(1)有效碰撞
(2)能量 取向
@@有效碰撞
@@
(1)活化分子 反应物分子
(2)活化能 反应热
查看更多完整答案,请扫码查看


