2025年新课程学习指导高中化学选择性必修1人教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年新课程学习指导高中化学选择性必修1人教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第16页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
1.氢气作为能源的优点和缺点有哪些?
答案:
提示:优点:①可用 H₂O 作为原料制备 H₂,H₂O 的来源丰富。②H₂ 的燃烧产物为 H₂O,没有污染。
缺点:①从 H₂O 中获取 H₂ 难度大。②氢气的储存和运输问题难解决。
缺点:①从 H₂O 中获取 H₂ 难度大。②氢气的储存和运输问题难解决。
2.已知H2的燃烧热为285.8kJ.mol−¹,则1g H2完全燃烧生成H2O(1)放出的热量为多少?写出计算式。
答案:
提示:$Q=\frac{1\ g}{2\ g\cdot mol^{-1}}\times285.8\ kJ\cdot mol^{-1}=142.9\ kJ$。
3.利用水煤气合成甲醇的反应为$CO(g)+2H_2(g)\xrightleftharpoons[]{}CH_3OH(g)$。
(1)化学上将断开或形成1mol化学键所吸收或放出的能量称为键能。已知相关的键能数据如下表所示,由此计算上述反应中生成1mol甲醇的能量变化是多少。
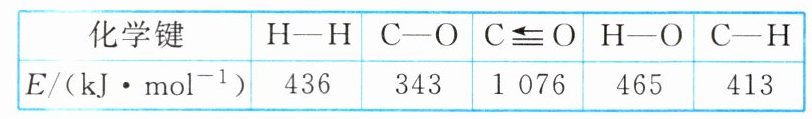
(2)又知反应$CO_2(g)+3H_2(g)\xrightleftharpoons[]{}CH_3OH(g)+H_2O(g)$中每生成1mol甲醇放出热量58kJ,计算反应$CO_2(g)+H_2(g)=CO(g)+H_2O(g)$
中每生成1molCO的能量变化是多少。
(1)化学上将断开或形成1mol化学键所吸收或放出的能量称为键能。已知相关的键能数据如下表所示,由此计算上述反应中生成1mol甲醇的能量变化是多少。

(2)又知反应$CO_2(g)+3H_2(g)\xrightleftharpoons[]{}CH_3OH(g)+H_2O(g)$中每生成1mol甲醇放出热量58kJ,计算反应$CO_2(g)+H_2(g)=CO(g)+H_2O(g)$
中每生成1molCO的能量变化是多少。
答案:
解析:把已知方程式按顺序编号为①②③。反应热等于断键吸收的能量与形成化学键所放出的能量的差值,则根据方程式$CO(g)+2H_{2}(g)\rightleftharpoons CH_{3}OH(g)$可知$\Delta H_{1}=1076\ kJ\cdot mol^{-1}+2\times436\ kJ\cdot mol^{-1}-3\times413\ kJ\cdot mol^{-1}-343\ kJ\cdot mol^{-1}-465\ kJ\cdot mol^{-1}=-99\ kJ\cdot mol^{-1}$。根据盖斯定律可知,反应② - ①即可得到反应③,则$\Delta H_{3}=-58\ kJ\cdot mol^{-1}+99\ kJ\cdot mol^{-1}=+41\ kJ\cdot mol^{-1}$。
答案:
(1)放出热量 99 kJ。
(2)吸收热量 41 kJ。
答案:
(1)放出热量 99 kJ。
(2)吸收热量 41 kJ。
太阳能与生物质能的开发利用
[情境素材1] 太阳能是一种清洁能源,地球上一年接受的太阳能总量远远大于人类对能源的需求量。
,目前,太阳能的开发利用已经受到人们的高度重视,并取得了较大的进展。在太阳能利用方面主要采用的技术有光电转换和光热转换。在这些技术中起关键作用的是光电转换材料和光热转换材料。主要的光电转换材料是硅和锗等半导体材料,新近开发的GaAs和CdS材料可实现低成本制造大面积太阳能电池,但目前转换效率较低,制造成本较高,大面积使用还有许多工作要做。
[情境素材2] 生物质是指除化石燃料以外的所有来源于地球生物圈的生物体或从生物体派生的可再生物质。生物质能则是指直接或间接地通过绿色植物的光合作用,把太阳能转化为化学能后固定和储藏在生物质内的能量。生物质能一直是人类赖以生存的重要能源,它是仅次于煤炭、石油和天然气而居于世界能源消费总量第四位的能源,在整个能源系统中占有重要地位。
1.根据情境素材1,可知太阳能的优点有哪些?目前利用光电转换技术开发太阳能有哪些缺点?
2.根据情境素材2,可知生物质能形成的原理是什么?
3.生物质来源广泛,请指出都有哪些来源。
[情境素材1] 太阳能是一种清洁能源,地球上一年接受的太阳能总量远远大于人类对能源的需求量。
,目前,太阳能的开发利用已经受到人们的高度重视,并取得了较大的进展。在太阳能利用方面主要采用的技术有光电转换和光热转换。在这些技术中起关键作用的是光电转换材料和光热转换材料。主要的光电转换材料是硅和锗等半导体材料,新近开发的GaAs和CdS材料可实现低成本制造大面积太阳能电池,但目前转换效率较低,制造成本较高,大面积使用还有许多工作要做。
[情境素材2] 生物质是指除化石燃料以外的所有来源于地球生物圈的生物体或从生物体派生的可再生物质。生物质能则是指直接或间接地通过绿色植物的光合作用,把太阳能转化为化学能后固定和储藏在生物质内的能量。生物质能一直是人类赖以生存的重要能源,它是仅次于煤炭、石油和天然气而居于世界能源消费总量第四位的能源,在整个能源系统中占有重要地位。
1.根据情境素材1,可知太阳能的优点有哪些?目前利用光电转换技术开发太阳能有哪些缺点?
2.根据情境素材2,可知生物质能形成的原理是什么?
3.生物质来源广泛,请指出都有哪些来源。
答案:
提示:优点:①分布广泛,不需开采和运输。②安全卫生,对环境无污染。③不存在枯竭问题。 缺点:①转换效率低。②转换设备制造成本较高。
@@提示:直接或间接通过植物的光合作用,把太阳能转化为化学能后固定和储藏在生物质内的能量。
@@提示:所有的植物、动物、微生物及其生产的废弃物。
@@提示:直接或间接通过植物的光合作用,把太阳能转化为化学能后固定和储藏在生物质内的能量。
@@提示:所有的植物、动物、微生物及其生产的废弃物。
爆炸可以瞬间完成,自然界中溶洞的形成却需要很长时间。要定量描述上述变化的反应速率,该如何表示呢?要改变上述变化的反应速率,可以采取什么措施呢?


答案:
略
(一)化学反应速率
1. 意义
表示化学反应快慢的物理量,可以用单位时间、单位体积中反应物或生成物的物质的量变化来表示。
2. 表示方法
如果反应体系的体积是恒定的,通常用单位时间内反应物浓度的_______或生成物浓度的_______来表示。
3. 表达式及单位
$v =$__________。常用单位是$mol/(L·s)$或$mol·L^{-1}·s^{-1}$等。
4. 不同物质表示的化学反应速率及其关系
对于化学反应:$mA + nB = pC + qD$。
(1)$v(A)=-\frac{\Delta c(A)}{\Delta t}$,$v(B)=$__________,$v(C)=\frac{\Delta c(C)}{\Delta t}$,$v(D)=$__________。
(2)$\frac{v(A)}{m}=$__________$=$__________$=$__________或$v(A):v(B):v(C):v(D)=$__________。
5. 化学反应速率的测定
(1)任何一种与物质浓度有关的可观测量都可以加以利用,如气体的________、体系的________、颜色的________、光的吸收、导电能力等。
(2)当反应物或生成物本身有比较明显的颜色时,人们常常利用颜色变化与浓度变化间的比例关系来测量反应速率。
[微点拨] 化学反应速率的使用注意事项
①单位时间内物质的量变化或质量变化不能表示反应速率。
②同一反应,不同物质表示的反应速率,其数值不一定相同。
③不能用纯液体或固体表示反应速率。
1. 意义
表示化学反应快慢的物理量,可以用单位时间、单位体积中反应物或生成物的物质的量变化来表示。
2. 表示方法
如果反应体系的体积是恒定的,通常用单位时间内反应物浓度的_______或生成物浓度的_______来表示。
3. 表达式及单位
$v =$__________。常用单位是$mol/(L·s)$或$mol·L^{-1}·s^{-1}$等。
4. 不同物质表示的化学反应速率及其关系
对于化学反应:$mA + nB = pC + qD$。
(1)$v(A)=-\frac{\Delta c(A)}{\Delta t}$,$v(B)=$__________,$v(C)=\frac{\Delta c(C)}{\Delta t}$,$v(D)=$__________。
(2)$\frac{v(A)}{m}=$__________$=$__________$=$__________或$v(A):v(B):v(C):v(D)=$__________。
5. 化学反应速率的测定
(1)任何一种与物质浓度有关的可观测量都可以加以利用,如气体的________、体系的________、颜色的________、光的吸收、导电能力等。
(2)当反应物或生成物本身有比较明显的颜色时,人们常常利用颜色变化与浓度变化间的比例关系来测量反应速率。
[微点拨] 化学反应速率的使用注意事项
①单位时间内物质的量变化或质量变化不能表示反应速率。
②同一反应,不同物质表示的反应速率,其数值不一定相同。
③不能用纯液体或固体表示反应速率。
答案:
减小 增大
@@$\frac{\Delta c}{\Delta t}$
@@
(1) $-\frac{\Delta c(\mathrm{B})}{\Delta t}$ $\frac{\Delta c(\mathrm{D})}{\Delta t}$
(2) $\frac{v(\mathrm{B})}{n}$ $\frac{v(\mathrm{C})}{p}$ $\frac{v(\mathrm{D})}{q}$ $m:n:p:q$
@@
(1) 体积 压强 深浅
@@$\frac{\Delta c}{\Delta t}$
@@
(1) $-\frac{\Delta c(\mathrm{B})}{\Delta t}$ $\frac{\Delta c(\mathrm{D})}{\Delta t}$
(2) $\frac{v(\mathrm{B})}{n}$ $\frac{v(\mathrm{C})}{p}$ $\frac{v(\mathrm{D})}{q}$ $m:n:p:q$
@@
(1) 体积 压强 深浅
查看更多完整答案,请扫码查看


