2025年新课程学习指导高中化学选择性必修1人教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年新课程学习指导高中化学选择性必修1人教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第7页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
写出下列反应的热化学方程式。
(1)Si与Cl两元素的单质反应生成1 mol Si的最高价化合物,恢复至室温,放热687 kJ,已知该化合物的熔、沸点分别为-69℃和58℃。写出该反应的热化学方程式:____________________。
(2)NaBH₄(s)与H₂O(l)反应生成NaBO₂(s)和H₂(g)。在25℃、101 kPa下,已知每消耗3.8 g NaBH₄(s)放热21.6 kJ,该反应的热化学方程式是______________________________。
(1)Si与Cl两元素的单质反应生成1 mol Si的最高价化合物,恢复至室温,放热687 kJ,已知该化合物的熔、沸点分别为-69℃和58℃。写出该反应的热化学方程式:____________________。
(2)NaBH₄(s)与H₂O(l)反应生成NaBO₂(s)和H₂(g)。在25℃、101 kPa下,已知每消耗3.8 g NaBH₄(s)放热21.6 kJ,该反应的热化学方程式是______________________________。
答案:
(1)Si(s)+2Cl₂(g)=SiCl₄(l) $\Delta H=-687\ kJ\cdot mol^{-1}$
(2)NaBH₄(s)+2H₂O(l)=NaBO₂(s)+4H₂(g) $\Delta H=-216.0\ kJ\cdot mol^{-1}$
(1)Si(s)+2Cl₂(g)=SiCl₄(l) $\Delta H=-687\ kJ\cdot mol^{-1}$
(2)NaBH₄(s)+2H₂O(l)=NaBO₂(s)+4H₂(g) $\Delta H=-216.0\ kJ\cdot mol^{-1}$
1. 反应物X生成Z的能量变化如右图所示,该反应的热化学方程式为( )
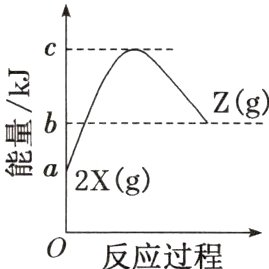
A. 2X(g)$\xlongequal[]{}$Z(g) $\Delta H=-(a - b)$kJ·mol⁻¹
B. 2X(g)$\xlongequal[]{}$Z(g) $\Delta H=-(b - a)$kJ·mol⁻¹
C. 2X(g)$\xlongequal[]{}$Z(g) $\Delta H=-(c - a)$kJ·mol⁻¹
D. 2X(g)$\xlongequal[]{}$Z(g) $\Delta H=-(b - c)$kJ·mol⁻¹

A. 2X(g)$\xlongequal[]{}$Z(g) $\Delta H=-(a - b)$kJ·mol⁻¹
B. 2X(g)$\xlongequal[]{}$Z(g) $\Delta H=-(b - a)$kJ·mol⁻¹
C. 2X(g)$\xlongequal[]{}$Z(g) $\Delta H=-(c - a)$kJ·mol⁻¹
D. 2X(g)$\xlongequal[]{}$Z(g) $\Delta H=-(b - c)$kJ·mol⁻¹
答案:
A
查看更多完整答案,请扫码查看


