2025年高考总复习首选用卷化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年高考总复习首选用卷化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第90页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
- 第131页
- 第132页
- 第133页
- 第134页
- 第135页
- 第136页
- 第137页
- 第138页
- 第139页
- 第140页
- 第141页
- 第142页
- 第143页
- 第144页
- 第145页
- 第146页
- 第147页
- 第148页
- 第149页
- 第150页
- 第151页
- 第152页
- 第153页
- 第154页
- 第155页
- 第156页
- 第157页
- 第158页
- 第159页
- 第160页
- 第161页
- 第162页
- 第163页
- 第164页
- 第165页
- 第166页
- 第167页
- 第168页
- 第169页
- 第170页
- 第171页
- 第172页
- 第173页
- 第174页
- 第175页
- 第176页
- 第177页
- 第178页
- 第179页
- 第180页
- 第181页
- 第182页
- 第183页
- 第184页
- 第185页
- 第186页
- 第187页
- 第188页
- 第189页
- 第190页
- 第191页
- 第192页
- 第193页
- 第194页
- 第195页
- 第196页
- 第197页
- 第198页
- 第199页
- 第200页
- 第201页
- 第202页
- 第203页
- 第204页
- 第205页
- 第206页
- 第207页
- 第208页
- 第209页
- 第210页
- 第211页
- 第212页
- 第213页
- 第214页
- 第215页
- 第216页
- 第217页
- 第218页
- 第219页
- 第220页
- 第221页
- 第222页
- 第223页
- 第224页
- 第225页
- 第226页
- 第227页
- 第228页
17. (2021·全国乙卷节选)(1)氯铂酸钡($BaPtCl_6$)固体加热时部分分解为$BaCl_2$、$Pt$和$Cl_2$,$376.8\ ^{\circ}C$时平衡常数$K_p' = 1.0×10^4\ Pa^2$。在一硬质玻璃烧瓶中加入过量$BaPtCl_6$,抽真空后,通过一支管通入碘蒸气(然后将支管封闭)。在$376.8\ ^{\circ}C$,碘蒸气初始压强为20.0 kPa。$376.8\ ^{\circ}C$平衡时,测得烧瓶中压强为32.5 kPa,则$p_{ICl}=$________kPa,反应$2ICl(g)=Cl_2(g)+I_2(g)$的平衡常数$K =$________(列出计算式即可)。
(2)McMorris测定和计算了在$136~180\ ^{\circ}C$范围内下列反应的平衡常数$K_p$:
$2NO(g)+2ICl(g)\rightleftharpoons 2NOCl(g)+I_2(g)$ $K_{p1}$
$2NOCl(g)\rightleftharpoons 2NO(g)+Cl_2(g)$ $K_{p2}$
得到$\lg K_{p1}~\frac{1}{T}$和$\lg K_{p2}~\frac{1}{T}$均为线性关系,如下图所示:
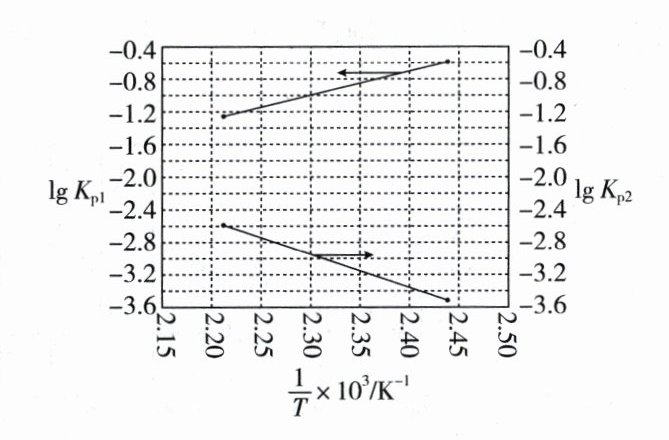
①由图可知,$NOCl$分解为$NO$和$Cl_2$反应的$\Delta H$________0(填“大于”或“小于”)。
②反应$2ICl(g)=Cl_2(g)+I_2(g)$的$K =$________(用$K_{p1}$、$K_{p2}$表示);该反应的$\Delta H$________0(填“大于”或“小于”),写出推理过程______________________________。
(2)McMorris测定和计算了在$136~180\ ^{\circ}C$范围内下列反应的平衡常数$K_p$:
$2NO(g)+2ICl(g)\rightleftharpoons 2NOCl(g)+I_2(g)$ $K_{p1}$
$2NOCl(g)\rightleftharpoons 2NO(g)+Cl_2(g)$ $K_{p2}$
得到$\lg K_{p1}~\frac{1}{T}$和$\lg K_{p2}~\frac{1}{T}$均为线性关系,如下图所示:

①由图可知,$NOCl$分解为$NO$和$Cl_2$反应的$\Delta H$________0(填“大于”或“小于”)。
②反应$2ICl(g)=Cl_2(g)+I_2(g)$的$K =$________(用$K_{p1}$、$K_{p2}$表示);该反应的$\Delta H$________0(填“大于”或“小于”),写出推理过程______________________________。
答案:
答案
(1)24.8 $\frac{100×(20×10^{3} - 12.4×10^{3})}{(24.8×10^{3})^{2}}$
(2)①大于 ②$K_{p1} \cdot K_{p2}$ 大于 设T'>T,即$\frac{1}{T'}<\frac{1}{T}$,由图可知: $\lg K_{p2}(T') - \lg K_{p2}(T)>|\lg K_{p1}(T') - \lg K_{p1}(T)|$ 则:$\lg [K_{p2}(T') \cdot K_{p1}(T')]>\lg [K_{p2}(T) \cdot K_{p1}(T)]$,即K(T')>K(T)。因此该反应正反应为吸热反应,即ΔH大于0。 解析
(1)由题意知376.8℃时玻璃烧瓶中发生两个反应:BaPtCl₆(s)⇌BaCl₂(s) + Pt(s) + 2Cl₂(g)、Cl₂(g) + I₂(g)⇌2ICl(g)。BaPtCl₆(s)⇌BaCl₂(s) + Pt(s) + 2Cl₂(g)的平衡常数$K_{p}' = 1.0×10^{4} Pa^{2}$,则平衡时$p^{2}(Cl_{2}) = 1.0×10^{4} Pa^{2}$,$p(Cl_{2}) = 100 Pa$,设到达平衡时I₂(g)的分压减小p kPa,则 Cl₂(g) + I₂(g) ⇌ 2ICl(g) 开始/kPa 20.0 0 变化/kPa p 2p 平衡/kPa 0.1 20.0 - p 2p 376.8℃平衡时,测得烧瓶中压强为32.5 kPa,则0.1 + 20.0 + p = 32.5,解得p = 12.4,则平衡时$p_{ICl} = 2p kPa = 2×12.4 kPa = 24.8 kPa$;则平衡时,I₂(g)的分压为(20.0 - p) kPa = (20×10³ - 12.4×10³) Pa,$p_{ICl} = 24.8 kPa = 24.8×10^{3} Pa$,$p(Cl_{2}) = 0.1 kPa = 100 Pa$,因此反应2ICl(g)⇌Cl₂(g) + I₂(g)的平衡常数$K = \frac{100×(20×10^{3} - 12.4×10^{3})}{(24.8×10^{3})^{2}}$。
(2)①结合题图可知,温度越高,$\frac{1}{T}$越小,$\lg K_{p2}$越大,即T越大,$K_{p2}$越大,说明升高温度平衡2NOCl(g)⇌2NO(g) + Cl₂(g)正向移动,则NOCl分解为NO和Cl₂反应的ΔH大于0。 ②Ⅰ. 2NO(g) + 2ICl(g)⇌2NOCl(g) + I₂(g) $K_{p1}$ Ⅱ. 2NOCl(g)⇌2NO(g) + Cl₂(g) $K_{p2}$ Ⅰ + Ⅱ得2ICl(g)⇌Cl₂(g) + I₂(g),则2ICl(g)⇌Cl₂(g) + I₂(g)的K = $K_{p1} \cdot K_{p2}$。
(1)24.8 $\frac{100×(20×10^{3} - 12.4×10^{3})}{(24.8×10^{3})^{2}}$
(2)①大于 ②$K_{p1} \cdot K_{p2}$ 大于 设T'>T,即$\frac{1}{T'}<\frac{1}{T}$,由图可知: $\lg K_{p2}(T') - \lg K_{p2}(T)>|\lg K_{p1}(T') - \lg K_{p1}(T)|$ 则:$\lg [K_{p2}(T') \cdot K_{p1}(T')]>\lg [K_{p2}(T) \cdot K_{p1}(T)]$,即K(T')>K(T)。因此该反应正反应为吸热反应,即ΔH大于0。 解析
(1)由题意知376.8℃时玻璃烧瓶中发生两个反应:BaPtCl₆(s)⇌BaCl₂(s) + Pt(s) + 2Cl₂(g)、Cl₂(g) + I₂(g)⇌2ICl(g)。BaPtCl₆(s)⇌BaCl₂(s) + Pt(s) + 2Cl₂(g)的平衡常数$K_{p}' = 1.0×10^{4} Pa^{2}$,则平衡时$p^{2}(Cl_{2}) = 1.0×10^{4} Pa^{2}$,$p(Cl_{2}) = 100 Pa$,设到达平衡时I₂(g)的分压减小p kPa,则 Cl₂(g) + I₂(g) ⇌ 2ICl(g) 开始/kPa 20.0 0 变化/kPa p 2p 平衡/kPa 0.1 20.0 - p 2p 376.8℃平衡时,测得烧瓶中压强为32.5 kPa,则0.1 + 20.0 + p = 32.5,解得p = 12.4,则平衡时$p_{ICl} = 2p kPa = 2×12.4 kPa = 24.8 kPa$;则平衡时,I₂(g)的分压为(20.0 - p) kPa = (20×10³ - 12.4×10³) Pa,$p_{ICl} = 24.8 kPa = 24.8×10^{3} Pa$,$p(Cl_{2}) = 0.1 kPa = 100 Pa$,因此反应2ICl(g)⇌Cl₂(g) + I₂(g)的平衡常数$K = \frac{100×(20×10^{3} - 12.4×10^{3})}{(24.8×10^{3})^{2}}$。
(2)①结合题图可知,温度越高,$\frac{1}{T}$越小,$\lg K_{p2}$越大,即T越大,$K_{p2}$越大,说明升高温度平衡2NOCl(g)⇌2NO(g) + Cl₂(g)正向移动,则NOCl分解为NO和Cl₂反应的ΔH大于0。 ②Ⅰ. 2NO(g) + 2ICl(g)⇌2NOCl(g) + I₂(g) $K_{p1}$ Ⅱ. 2NOCl(g)⇌2NO(g) + Cl₂(g) $K_{p2}$ Ⅰ + Ⅱ得2ICl(g)⇌Cl₂(g) + I₂(g),则2ICl(g)⇌Cl₂(g) + I₂(g)的K = $K_{p1} \cdot K_{p2}$。
18. (2023·金版原创)2023年全国两会于3月15日在北京顺利闭幕,环境问题是大会的热点议题,“碳达峰、碳中和”依然是与会代表高度关注的问题,当前对二氧化碳的回收利用显得尤为重要。二氧化碳转化为低碳烯烃涉及的部分反应为:
(Ⅰ)$2CO_2(g)+6H_2(g)\rightleftharpoons C_2H_4(g)+4H_2O(g)$ $\Delta H_1 = -268.65\ kJ\cdot mol^{-1}$
(Ⅱ)$3CO_2(g)+9H_2(g)\rightleftharpoons C_3H_6(g)+6H_2O(g)$ $\Delta H_2 = -131.50\ kJ\cdot mol^{-1}$
(Ⅲ)$4CO_2(g)+12H_2(g)\rightleftharpoons C_4H_8(g)+8H_2O(g)$ $\Delta H_3 = -380.22\ kJ\cdot mol^{-1}$
(1)反应$2C_3H_6(g)=C_2H_4(g)+C_4H_8(g)$的$\Delta H =$________$kJ\cdot mol^{-1}$。
(2)恒容密闭容器中可逆反应$3CO_2(g)+9H_2(g)\rightleftharpoons C_3H_6(g)+6H_2O(g)$达到平衡的标志是________。
A. 单位时间内生成1 mol $CO_2$的同时消耗1 mol $C_3H_6$
B. 混合气体的密度不再改变
C. 反应速率$v(CO_2):v(H_2):v(C_3H_6):v(H_2O)=3:9:1:6$
D. 混合气体的平均相对分子质量不再改变
(3)在总压强恒为3.1 MPa,$\frac{n(H_2)}{n(CO_2)} = 3$时,当只发生反应(Ⅰ)时,平衡时各物质的百分组成$x$如下图所示:
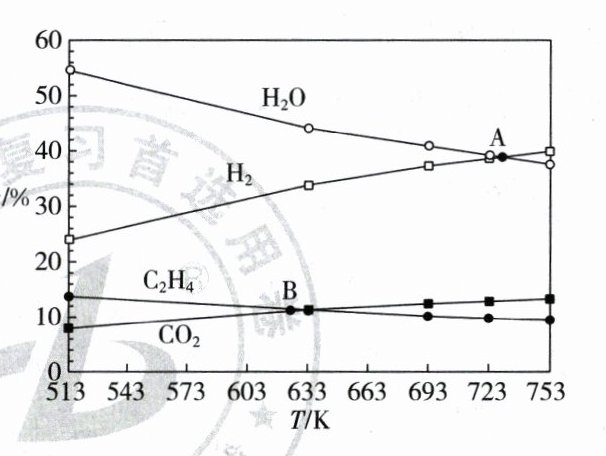
A点时$CO_2$平衡转化率为________,乙烯的分压为________MPa;B点对应温度下反应(Ⅰ)的压强平衡常数$K_p =$________$(MPa)^{-3}$(保留一位小数)。
(Ⅰ)$2CO_2(g)+6H_2(g)\rightleftharpoons C_2H_4(g)+4H_2O(g)$ $\Delta H_1 = -268.65\ kJ\cdot mol^{-1}$
(Ⅱ)$3CO_2(g)+9H_2(g)\rightleftharpoons C_3H_6(g)+6H_2O(g)$ $\Delta H_2 = -131.50\ kJ\cdot mol^{-1}$
(Ⅲ)$4CO_2(g)+12H_2(g)\rightleftharpoons C_4H_8(g)+8H_2O(g)$ $\Delta H_3 = -380.22\ kJ\cdot mol^{-1}$
(1)反应$2C_3H_6(g)=C_2H_4(g)+C_4H_8(g)$的$\Delta H =$________$kJ\cdot mol^{-1}$。
(2)恒容密闭容器中可逆反应$3CO_2(g)+9H_2(g)\rightleftharpoons C_3H_6(g)+6H_2O(g)$达到平衡的标志是________。
A. 单位时间内生成1 mol $CO_2$的同时消耗1 mol $C_3H_6$
B. 混合气体的密度不再改变
C. 反应速率$v(CO_2):v(H_2):v(C_3H_6):v(H_2O)=3:9:1:6$
D. 混合气体的平均相对分子质量不再改变
(3)在总压强恒为3.1 MPa,$\frac{n(H_2)}{n(CO_2)} = 3$时,当只发生反应(Ⅰ)时,平衡时各物质的百分组成$x$如下图所示:

A点时$CO_2$平衡转化率为________,乙烯的分压为________MPa;B点对应温度下反应(Ⅰ)的压强平衡常数$K_p =$________$(MPa)^{-3}$(保留一位小数)。
答案:
答案
(1) - 385.87
(2)D
(3)60% 0.3 8.6 解析
(1)目标反应 = 反应Ⅰ + 反应Ⅲ - 2×反应Ⅱ,ΔH = ΔH₁ + ΔH₃ - 2ΔH₂ = - 268.65 kJ·mol⁻¹ - 380.22 kJ·mol⁻¹ + 2×131.50 kJ·mol⁻¹ = - 385.87 kJ·mol⁻¹。
(3)由题意可得,假设起始$n(CO_{2}) = 2 mol$,$n(H_{2}) = 6 mol$,平衡时生成$n(C_{2}H_{4}) = x mol$,则列式: 2CO₂(g) + 6H₂(g)⇌C₂H₄(g) + 4H₂O(g) 起始(mol) 2 6 0 0 平衡(mol) 2 - 2x 6 - 6x x 4x 在A点:6 - 6x = 4x,x = 0.6 $p(C_{2}H_{4}) = \frac{x}{8 - 3x}×3.1 MPa = 0.3 MPa$ 在B点:2 - 2x = x,$x = \frac{2}{3}$,CO₂、H₂、C₂H₄、H₂O的物质的量分数依次为$\frac{1}{9}$、$\frac{1}{3}$、$\frac{1}{9}$、$\frac{4}{9}$ $K_{p} = \frac{p(C_{2}H_{4}) \cdot p^{4}(H_{2}O)}{p^{2}(CO_{2}) \cdot p^{6}(H_{2})} = \frac{(\frac{1}{9}×3.1)×(\frac{4}{9}×3.1)^{4}}{(\frac{1}{9}×3.1)^{2}×(\frac{1}{3}×3.1)^{6}}(MPa)^{-3} = \frac{256}{3.1^{3}}(MPa)^{-3}≈8.6(MPa)^{-3}$。
(1) - 385.87
(2)D
(3)60% 0.3 8.6 解析
(1)目标反应 = 反应Ⅰ + 反应Ⅲ - 2×反应Ⅱ,ΔH = ΔH₁ + ΔH₃ - 2ΔH₂ = - 268.65 kJ·mol⁻¹ - 380.22 kJ·mol⁻¹ + 2×131.50 kJ·mol⁻¹ = - 385.87 kJ·mol⁻¹。
(3)由题意可得,假设起始$n(CO_{2}) = 2 mol$,$n(H_{2}) = 6 mol$,平衡时生成$n(C_{2}H_{4}) = x mol$,则列式: 2CO₂(g) + 6H₂(g)⇌C₂H₄(g) + 4H₂O(g) 起始(mol) 2 6 0 0 平衡(mol) 2 - 2x 6 - 6x x 4x 在A点:6 - 6x = 4x,x = 0.6 $p(C_{2}H_{4}) = \frac{x}{8 - 3x}×3.1 MPa = 0.3 MPa$ 在B点:2 - 2x = x,$x = \frac{2}{3}$,CO₂、H₂、C₂H₄、H₂O的物质的量分数依次为$\frac{1}{9}$、$\frac{1}{3}$、$\frac{1}{9}$、$\frac{4}{9}$ $K_{p} = \frac{p(C_{2}H_{4}) \cdot p^{4}(H_{2}O)}{p^{2}(CO_{2}) \cdot p^{6}(H_{2})} = \frac{(\frac{1}{9}×3.1)×(\frac{4}{9}×3.1)^{4}}{(\frac{1}{9}×3.1)^{2}×(\frac{1}{3}×3.1)^{6}}(MPa)^{-3} = \frac{256}{3.1^{3}}(MPa)^{-3}≈8.6(MPa)^{-3}$。
查看更多完整答案,请扫码查看


