2025年高考总复习首选用卷化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年高考总复习首选用卷化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第55页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
- 第131页
- 第132页
- 第133页
- 第134页
- 第135页
- 第136页
- 第137页
- 第138页
- 第139页
- 第140页
- 第141页
- 第142页
- 第143页
- 第144页
- 第145页
- 第146页
- 第147页
- 第148页
- 第149页
- 第150页
- 第151页
- 第152页
- 第153页
- 第154页
- 第155页
- 第156页
- 第157页
- 第158页
- 第159页
- 第160页
- 第161页
- 第162页
- 第163页
- 第164页
- 第165页
- 第166页
- 第167页
- 第168页
- 第169页
- 第170页
- 第171页
- 第172页
- 第173页
- 第174页
- 第175页
- 第176页
- 第177页
- 第178页
- 第179页
- 第180页
- 第181页
- 第182页
- 第183页
- 第184页
- 第185页
- 第186页
- 第187页
- 第188页
- 第189页
- 第190页
- 第191页
- 第192页
- 第193页
- 第194页
- 第195页
- 第196页
- 第197页
- 第198页
- 第199页
- 第200页
- 第201页
- 第202页
- 第203页
- 第204页
- 第205页
- 第206页
- 第207页
- 第208页
- 第209页
- 第210页
- 第211页
- 第212页
- 第213页
- 第214页
- 第215页
- 第216页
- 第217页
- 第218页
- 第219页
- 第220页
- 第221页
- 第222页
- 第223页
- 第224页
- 第225页
- 第226页
- 第227页
- 第228页
1.(2023·海南卷)铍的氧化物广泛应用于原子能、航天、电子、陶瓷等领域,是重要的战略物资。利用绿柱石(主要化学成分为$Be_3Al_2Si_6O_{18}$,还含有一定量的$FeO$和$Fe_2O_3$)生产$BeO$的一种工艺流程如下。
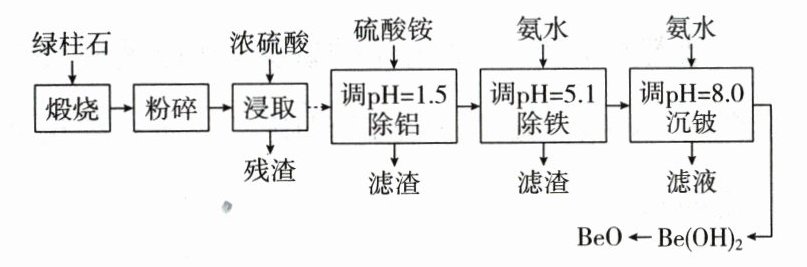
回答问题:
(1)$Be_3Al_2Si_6O_{18}$中$Be$的化合价为 。
(2)粉碎的目的是 ;残渣主要成分是 (填化学式)。
(3)该流程中能循环使用的物质是 (填化学式)。
(4)无水$BeCl_2$可用作聚合反应的催化剂。$BeO$、$Cl_2$与足量$C$在$600~800\ ^{\circ}C$制备$BeCl_2$的化学方程式为 。
(5)沉铍时,将$pH$从$8.0$提高到$8.5$,则铍的损失降低至原来的 $\%$。

回答问题:
(1)$Be_3Al_2Si_6O_{18}$中$Be$的化合价为 。
(2)粉碎的目的是 ;残渣主要成分是 (填化学式)。
(3)该流程中能循环使用的物质是 (填化学式)。
(4)无水$BeCl_2$可用作聚合反应的催化剂。$BeO$、$Cl_2$与足量$C$在$600~800\ ^{\circ}C$制备$BeCl_2$的化学方程式为 。
(5)沉铍时,将$pH$从$8.0$提高到$8.5$,则铍的损失降低至原来的 $\%$。
答案:
+2@@增大反应物的接触面积,加快反应速率,提高浸取率@@$SiO_2$@@$(NH_4)_2SO_4$@@$BeO + Cl_2 + C\xlongequal{600~800^{\circ}C}CO + BeCl_2$@@10
2.(2023·湖北卷)$SiCl_4$是生产多晶硅的副产物。利用$SiCl_4$对废弃的锂电池正极材料$LiCoO_2$进行氯化处理以回收$Li$、$Co$等金属,工艺路线如下:
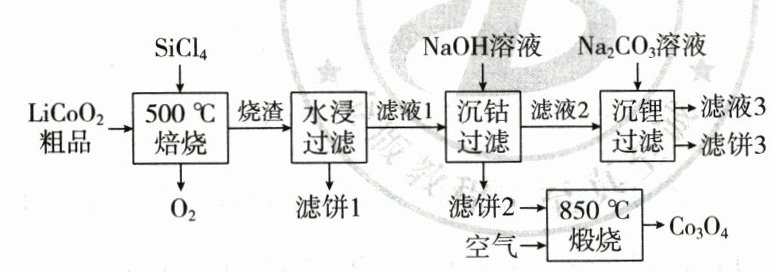
回答下列问题:
(1)$Co$位于元素周期表第 周期,第 族。
(2)烧渣是$LiCl$、$CoCl_2$和$SiO_2$的混合物,“$500\ ^{\circ}C$焙烧”后剩余的$SiCl_4$应先除去,否则水浸时会产生大量烟雾,用化学方程式表示其原因 。
(3)鉴别洗净的“滤饼3”和固体$Na_2CO_3$常用方法的名称是 。
(4)已知$K_{sp}[Co(OH)_2]=5.9\times10^{-15}$,若“沉钴过滤”的$pH$控制为$10.0$,则溶液中$Co^{2 + }$浓度为 $mol\cdot L^{-1}$。“$850\ ^{\circ}C$煅烧”时的化学方程式为 。
(5)导致$SiCl_4$比$CCl_4$易水解的因素有 (填标号)。
a.$Si—Cl$键极性更大 b.$Si$的原子半径更大
c.$Si—Cl$键键能更大 d.$Si$有更多的价层轨道

回答下列问题:
(1)$Co$位于元素周期表第 周期,第 族。
(2)烧渣是$LiCl$、$CoCl_2$和$SiO_2$的混合物,“$500\ ^{\circ}C$焙烧”后剩余的$SiCl_4$应先除去,否则水浸时会产生大量烟雾,用化学方程式表示其原因 。
(3)鉴别洗净的“滤饼3”和固体$Na_2CO_3$常用方法的名称是 。
(4)已知$K_{sp}[Co(OH)_2]=5.9\times10^{-15}$,若“沉钴过滤”的$pH$控制为$10.0$,则溶液中$Co^{2 + }$浓度为 $mol\cdot L^{-1}$。“$850\ ^{\circ}C$煅烧”时的化学方程式为 。
(5)导致$SiCl_4$比$CCl_4$易水解的因素有 (填标号)。
a.$Si—Cl$键极性更大 b.$Si$的原子半径更大
c.$Si—Cl$键键能更大 d.$Si$有更多的价层轨道
答案:
四@@Ⅷ@@$SiCl_4 + 3H_2O = H_2SiO_3 + 4HCl$@@焰色试验@@$5.9×10^{-7}$@@$6Co(OH)_2 + O_2\xlongequal{850^{\circ}C}2Co_3O_4 + 6H_2O$@@abd
3.(2023·全国乙卷)$LiMn_2O_4$作为一种新型锂电池正极材料受到广泛关注。由菱锰矿($MnCO_3$,含有少量$Si$、$Fe$、$Ni$、$Al$等元素)制备$LiMn_2O_4$的流程如下:
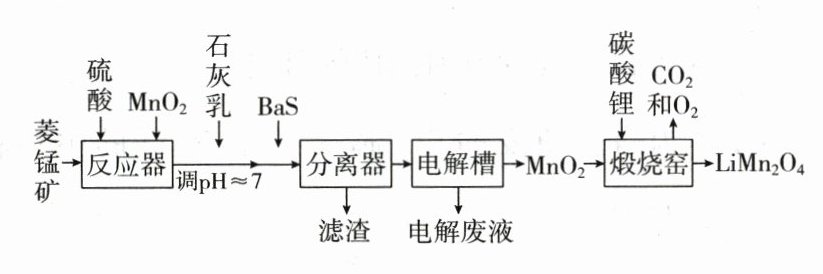
已知:$K_{sp}[Fe(OH)_3]=2.8\times10^{-39}$,$K_{sp}[Al(OH)_3]=1.3\times10^{-33}$,$K_{sp}[Ni(OH)_2]=5.5\times10^{-16}$。
回答下列问题:
(1)硫酸溶矿主要反应化学方程式为 。为提高溶矿速率,可采取的措施 (举1例)。
(2)加入少量$MnO_2$的作用是 。不宜使用$H_2O_2$替代$MnO_2$,原因是 。
(3)溶矿反应完成后,反应器中溶液$pH = 4$,此时$c(Fe^{3 + })=$ $mol\cdot L^{-1}$;用石灰乳调节至$pH\approx7$,除去的金属离子是 。
(4)加入少量$BaS$溶液除去$Ni^{2 + }$,生成的沉淀有 。
(5)在电解槽中,发生电解反应的离子方程式为 。随着电解反应进行,为保持电解液成分稳定,应不断 。电解废液可在反应器中循环利用。
(6)煅烧窑中,生成$LiMn_2O_4$反应的化学方程式是 。

已知:$K_{sp}[Fe(OH)_3]=2.8\times10^{-39}$,$K_{sp}[Al(OH)_3]=1.3\times10^{-33}$,$K_{sp}[Ni(OH)_2]=5.5\times10^{-16}$。
回答下列问题:
(1)硫酸溶矿主要反应化学方程式为 。为提高溶矿速率,可采取的措施 (举1例)。
(2)加入少量$MnO_2$的作用是 。不宜使用$H_2O_2$替代$MnO_2$,原因是 。
(3)溶矿反应完成后,反应器中溶液$pH = 4$,此时$c(Fe^{3 + })=$ $mol\cdot L^{-1}$;用石灰乳调节至$pH\approx7$,除去的金属离子是 。
(4)加入少量$BaS$溶液除去$Ni^{2 + }$,生成的沉淀有 。
(5)在电解槽中,发生电解反应的离子方程式为 。随着电解反应进行,为保持电解液成分稳定,应不断 。电解废液可在反应器中循环利用。
(6)煅烧窑中,生成$LiMn_2O_4$反应的化学方程式是 。
答案:
$MnCO_3 + H_2SO_4 = MnSO_4 + H_2O + CO_2↑$@@粉碎菱锰矿(合理即可)@@将$Fe^{2+}$氧化为$Fe^{3+}$@@$Fe^{3+}$可以催化$H_2O_2$分解@@$2.8×10^{-9}$@@$Al^{3+}$@@$BaSO_4$、$NiS$@@$Mn^{2+} + 2H_2O\xlongequal{电解}H_2↑ + MnO_2↓ + 2H^{+}$@@加入$Mn(OH)_2$@@$2Li_2CO_3 + 8MnO_2\xlongequal{煅烧}4LiMn_2O_4 + 2CO_2↑ + O_2↑$
查看更多完整答案,请扫码查看


