2026年新高考5年真题高中化学全一册通用版广东专版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年新高考5年真题高中化学全一册通用版广东专版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第78页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
7. [2025·云南卷,9T,3分]钙霞石是一种生产玻璃陶瓷的原料,所含M、Q、R、T、X、Y、Z为原子序数依次增大的前20号主族元素,M是原子半径最小的元素,Q是形成物质种类最多的元素,R是地壳中含量最高的元素;T、X、Y同周期,Q、X均与Y相邻,Z的原子序数等于M、R和T的原子序数之和。下列说法正确的是 (
A.M与Z可形成离子化合物
B.原子半径:R<T<X
C.$ QR_2$ 是极性分子
D.电负性:Y<R<Q
A
)A.M与Z可形成离子化合物
B.原子半径:R<T<X
C.$ QR_2$ 是极性分子
D.电负性:Y<R<Q
答案:
7. 参考答案 A
命题意图:本题以钙霞石为载体,考查元素推断与周期律应用,体现了“证据推理与模型认知”等化学学科核心素养。
解题思路:M是原子半径最小的元素,M为H元素;Q形成物质种类最多,Q为C元素;R地壳中含量最高,R为O元素;T、X、Y同周期且原子序数递增,Q(C)、X均与Y相邻,并结合钙霞石是一种生产玻璃陶瓷的原料,则X为Al元素,Y为Si元素,结合Z的原子序数等于M、R和T原子序数之和,且小于等于20,则T为Na元素,Z为Ca元素。H与Ca形成CaH₂,为离子化合物,A项正确。同周期主族元素的原子半径从左到右逐渐减小,同主族元素的原子半径从上到下逐渐增大,则原子半径O<Al<Na,B项错误。CO₂的空间结构为直线形,正电中心和负电中心重合,为非极性分子,C项错误。同周期的主族元素电负性从左到右逐渐增大,同主族元素的电负性从上到下逐渐减小,则电负性Si<C<O,D项错误。
命题意图:本题以钙霞石为载体,考查元素推断与周期律应用,体现了“证据推理与模型认知”等化学学科核心素养。
解题思路:M是原子半径最小的元素,M为H元素;Q形成物质种类最多,Q为C元素;R地壳中含量最高,R为O元素;T、X、Y同周期且原子序数递增,Q(C)、X均与Y相邻,并结合钙霞石是一种生产玻璃陶瓷的原料,则X为Al元素,Y为Si元素,结合Z的原子序数等于M、R和T原子序数之和,且小于等于20,则T为Na元素,Z为Ca元素。H与Ca形成CaH₂,为离子化合物,A项正确。同周期主族元素的原子半径从左到右逐渐减小,同主族元素的原子半径从上到下逐渐增大,则原子半径O<Al<Na,B项错误。CO₂的空间结构为直线形,正电中心和负电中心重合,为非极性分子,C项错误。同周期的主族元素电负性从左到右逐渐增大,同主族元素的电负性从上到下逐渐减小,则电负性Si<C<O,D项错误。
8. [2025·山东卷,8T,2分]物质性质与组成元素的性质有关,下列对物质性质差异解释错误的是 (

A
)
答案:
8. 参考答案 A
命题意图:本题考查物质结构与性质,涉及电离能、电负性、晶体性质等知识,体现了“证据推理与模型认知”等化学学科核心素养。
解题思路:H₂O沸点高于H₂S的主要原因是H₂O分子间存在氢键、H₂S分子间不存在氢键,与电离能无关,A项错误。HClO酸性强于HBrO是因为Cl的电负性大于Br,导致O - H键极性更强,更易解离出H⁺,B项正确。金刚石硬度大于晶体硅是因为二者均为共价晶体,C原子半径小于Si,C - C键键长更短、键能更大,C项正确。MgO和NaF均属于离子晶体,离子半径越小、离子所带电荷越多,对应离子晶体的熔点越高。所带电荷Mg²⁺>Na⁺,O²⁻>F⁻,故MgO中离子键更强,晶体熔点更高,D项正确。
命题意图:本题考查物质结构与性质,涉及电离能、电负性、晶体性质等知识,体现了“证据推理与模型认知”等化学学科核心素养。
解题思路:H₂O沸点高于H₂S的主要原因是H₂O分子间存在氢键、H₂S分子间不存在氢键,与电离能无关,A项错误。HClO酸性强于HBrO是因为Cl的电负性大于Br,导致O - H键极性更强,更易解离出H⁺,B项正确。金刚石硬度大于晶体硅是因为二者均为共价晶体,C原子半径小于Si,C - C键键长更短、键能更大,C项正确。MgO和NaF均属于离子晶体,离子半径越小、离子所带电荷越多,对应离子晶体的熔点越高。所带电荷Mg²⁺>Na⁺,O²⁻>F⁻,故MgO中离子键更强,晶体熔点更高,D项正确。
9. [2025·浙江1月卷,4T,3分]根据元素周期律,下列说法不正确的是 (
A.第一电离能:N>O>S
B.化合物中键的极性:$ SiCl_4> PCl_3$
C.碱性:$ LiOH> KOH$
D.化合物中离子键百分数:$ MgO> Al_2 O_3$
C
)A.第一电离能:N>O>S
B.化合物中键的极性:$ SiCl_4> PCl_3$
C.碱性:$ LiOH> KOH$
D.化合物中离子键百分数:$ MgO> Al_2 O_3$
答案:
9. 参考答案 C
命题意图:本题考查元素周期律及其应用,意在考查考生的理解记忆能力,体现了“证据推理与模型认知”等化学学科核心素养。
解题思路:同一周期从左到右,元素的第一电离能呈增大趋势;同主族元素从上到下,元素的第一电离能逐渐减小。基态N原子的2p能级处于半充满稳定状态,其第一电离能大于同周期相邻元素,故第一电离能N>O>S,A项正确。同一周期从左到右,元素的电负性依次增大,电负性Si<P<Cl,故化合物中键的极性SiCl₄>PCl₃,B项正确。同一主族从上到下,元素的金属性依次增大,最高价氧化物对应的水化物的碱性依次增大,金属性Li<K,故碱性LiOH<KOH,C项错误。电负性Mg<Al<O,Mg与O的电负性差值>Al与O的电负性差值,故化合物中离子键百分数MgO>Al₂O₃,D项正确。
命题意图:本题考查元素周期律及其应用,意在考查考生的理解记忆能力,体现了“证据推理与模型认知”等化学学科核心素养。
解题思路:同一周期从左到右,元素的第一电离能呈增大趋势;同主族元素从上到下,元素的第一电离能逐渐减小。基态N原子的2p能级处于半充满稳定状态,其第一电离能大于同周期相邻元素,故第一电离能N>O>S,A项正确。同一周期从左到右,元素的电负性依次增大,电负性Si<P<Cl,故化合物中键的极性SiCl₄>PCl₃,B项正确。同一主族从上到下,元素的金属性依次增大,最高价氧化物对应的水化物的碱性依次增大,金属性Li<K,故碱性LiOH<KOH,C项错误。电负性Mg<Al<O,Mg与O的电负性差值>Al与O的电负性差值,故化合物中离子键百分数MgO>Al₂O₃,D项正确。
10. [2025·河南卷,6T,3分]我国科研人员合成了一种深紫外双折射晶体材料,其由原子序数依次增大的五种短周期元素Q、W、X、Y和Z组成。基态X原子的s轨道中电子总数比p轨道中电子数多1,X所在族的族序数等于Q的质子数,基态Y和Z原子的原子核外均只有1个未成对电子,且二者核电荷数之和为Q的4倍。下列说法正确的是 (
A.QY₃ 为极性分子
B.ZY为共价晶体
C.原子半径:W>Z
D.1个X₂ 分子中有2个π键
D
)A.QY₃ 为极性分子
B.ZY为共价晶体
C.原子半径:W>Z
D.1个X₂ 分子中有2个π键
答案:
10. 参考答案 D
命题意图:本题结合深紫外双折射晶体材料,考查元素推断、分子极性、原子半径大小比较及化学键类型等知识,体现了“证据推理与模型认知”等化学学科核心素养。
解题思路:Q、W、X、Y和Z为原子序数依次增大的短周期元素,基态X原子的s轨道中电子总数比p轨道中电子数多1,则基态X原子的核外电子排布式为1s²2s²2p³,X是N元素;X所在族的族序数等于Q的质子数,Q是B元素,W是C元素;基态Y和Z原子的原子核外均只有1个未成对电子,且二者核电荷数之和为Q的4倍,即质子数之和为20,所以Y是F元素,Z是Na元素。BF₃的中心B原子的价层电子对数为3 + $\frac{3 - 3×1}{2}$ = 3,无孤电子对,BF₃的空间结构为平面正三角形,正电中心和负电中心重合,则BF₃为非极性分子,A项错误。NaF是离子晶体,B项错误。同周期的主族元素从左到右,原子半径逐渐减小,同主族从上到下原子半径逐渐增大,则原子半径C<Na,C项错误。N₂分子中含有氮氮三键,1个三键中含有1个σ键、2个π键,D项正确。
命题意图:本题结合深紫外双折射晶体材料,考查元素推断、分子极性、原子半径大小比较及化学键类型等知识,体现了“证据推理与模型认知”等化学学科核心素养。
解题思路:Q、W、X、Y和Z为原子序数依次增大的短周期元素,基态X原子的s轨道中电子总数比p轨道中电子数多1,则基态X原子的核外电子排布式为1s²2s²2p³,X是N元素;X所在族的族序数等于Q的质子数,Q是B元素,W是C元素;基态Y和Z原子的原子核外均只有1个未成对电子,且二者核电荷数之和为Q的4倍,即质子数之和为20,所以Y是F元素,Z是Na元素。BF₃的中心B原子的价层电子对数为3 + $\frac{3 - 3×1}{2}$ = 3,无孤电子对,BF₃的空间结构为平面正三角形,正电中心和负电中心重合,则BF₃为非极性分子,A项错误。NaF是离子晶体,B项错误。同周期的主族元素从左到右,原子半径逐渐减小,同主族从上到下原子半径逐渐增大,则原子半径C<Na,C项错误。N₂分子中含有氮氮三键,1个三键中含有1个σ键、2个π键,D项正确。
11. [2025·湖北卷,6T,3分]某化合物的分子式为XY₂Z。X、Y、Z三种元素位于同一短周期且原子序数依次增大,三者的原子核外电子层数之和与未成对电子数之和相等,Z是周期表中电负性最大的元素。下列说法正确的是 (
A.三者中Z的原子半径最大
B.三者中Y的第一电离能最小
C.X的最高化合价为+3
D.XZ₃ 与NH₃ 键角相等
B
)A.三者中Z的原子半径最大
B.三者中Y的第一电离能最小
C.X的最高化合价为+3
D.XZ₃ 与NH₃ 键角相等
答案:
11. 参考答案 B
命题意图:本题以元素推断为背景,考查原子结构、电负性、键角等知识,意在考查考生逻辑推理能力,体现了“证据推理与模型认知”等化学学科核心素养。
解题思路:Z是周期表中电负性最大的元素,Z为F,电子层数为2,未成对电子数为1;X、Y、Z三种元素位于同一短周期且原子序数依次增大,三者的原子核外电子层数之和与未成对电子数之和相等,则X和Y未成对电子数之和为5,则X为C、Y为N或X为N、Y为O;结合化合物的分子式为XY₂Z,则X为N,Y为O。同周期的主族元素从左到右,原子半径依次减小,三者中原子半径最大的是C,A项错误。同周期从左到右,元素的第一电离能呈增大趋势,N的2p轨道呈半充满的稳定结构,其第一电离能大于同周期相邻元素,故第一电离能O<N<F,B项正确。N原子的最外层电子数为5,则N的最高正化合价为 + 5,C项错误。NF₃和NH₃的中心原子均为sp³杂化,孤电子对数均为1,电负性F>H且原子半径F>H,NF₃中成键电子对离中心N较远,成键电子对之间的斥力较小,键角较小,D项错误。
命题意图:本题以元素推断为背景,考查原子结构、电负性、键角等知识,意在考查考生逻辑推理能力,体现了“证据推理与模型认知”等化学学科核心素养。
解题思路:Z是周期表中电负性最大的元素,Z为F,电子层数为2,未成对电子数为1;X、Y、Z三种元素位于同一短周期且原子序数依次增大,三者的原子核外电子层数之和与未成对电子数之和相等,则X和Y未成对电子数之和为5,则X为C、Y为N或X为N、Y为O;结合化合物的分子式为XY₂Z,则X为N,Y为O。同周期的主族元素从左到右,原子半径依次减小,三者中原子半径最大的是C,A项错误。同周期从左到右,元素的第一电离能呈增大趋势,N的2p轨道呈半充满的稳定结构,其第一电离能大于同周期相邻元素,故第一电离能O<N<F,B项正确。N原子的最外层电子数为5,则N的最高正化合价为 + 5,C项错误。NF₃和NH₃的中心原子均为sp³杂化,孤电子对数均为1,电负性F>H且原子半径F>H,NF₃中成键电子对离中心N较远,成键电子对之间的斥力较小,键角较小,D项错误。
12. [2025·河北卷,9T,3分]W、X、Y、Z为四种短周期非金属元素,W原子中电子排布已充满的能级数与最高能级中的电子数相等,X与W同族,Y与X相邻且Y原子比X原子多一个未成对电子,Z位于W的对角线位置。下列说法错误的是 (
A.第二电离能:X<Y
B.原子半径:Z<W
C.单质沸点:Y<Z
D.电负性:W<X
A
)A.第二电离能:X<Y
B.原子半径:Z<W
C.单质沸点:Y<Z
D.电负性:W<X
答案:
12. 参考答案 A
命题意图:本题考查元素推断和元素周期律,涉及电离能、原子半径、沸点、电负性等知识,体现了“证据推理与模型认知”等化学学科核心素养。
解题思路:W、X、Y、Z均为短周期非金属元素。
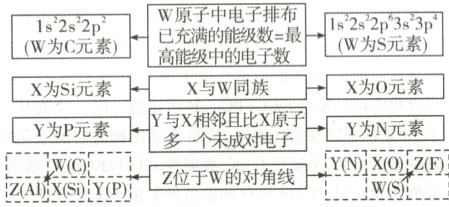
W原子中电子排布已充满的能级数 = 最高能级中的电子数,若W为C,则Z为Al,与四种元素均为非金属元素不符合。故W、X、Y、Z分别为S、O、N、F。基态O原子失去一个电子后,其核外电子排布式为1s²2s²2p³,基态N原子失去一个电子后电子排布式为1s²2s²2p²,基态O原子失去一个电子后2p能级为半充满的稳定结构,则第二电离能X(O)>Y(N),A项错误。同主族元素从上到下,原子半径逐渐增大,则原子半径O<S;同周期主族元素从左到右,原子半径逐渐减小,则原子半径Z(F)<W(S),B项正确。N₂和F₂均为分子晶体,一般来说,相对分子质量越大,沸点越高,则单质沸点N₂<F₂,C项正确。同主族元素从上到下,元素的电负性逐渐减小,则电负性W(S)<X(O),D项正确。
12. 参考答案 A
命题意图:本题考查元素推断和元素周期律,涉及电离能、原子半径、沸点、电负性等知识,体现了“证据推理与模型认知”等化学学科核心素养。
解题思路:W、X、Y、Z均为短周期非金属元素。

W原子中电子排布已充满的能级数 = 最高能级中的电子数,若W为C,则Z为Al,与四种元素均为非金属元素不符合。故W、X、Y、Z分别为S、O、N、F。基态O原子失去一个电子后,其核外电子排布式为1s²2s²2p³,基态N原子失去一个电子后电子排布式为1s²2s²2p²,基态O原子失去一个电子后2p能级为半充满的稳定结构,则第二电离能X(O)>Y(N),A项错误。同主族元素从上到下,原子半径逐渐增大,则原子半径O<S;同周期主族元素从左到右,原子半径逐渐减小,则原子半径Z(F)<W(S),B项正确。N₂和F₂均为分子晶体,一般来说,相对分子质量越大,沸点越高,则单质沸点N₂<F₂,C项正确。同主族元素从上到下,元素的电负性逐渐减小,则电负性W(S)<X(O),D项正确。
查看更多完整答案,请扫码查看


