2026年新高考5年真题高中化学全一册通用版广东专版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年新高考5年真题高中化学全一册通用版广东专版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第30页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
19. (14分)铬及其化合物在催化、金属防腐等方面具有重要应用。
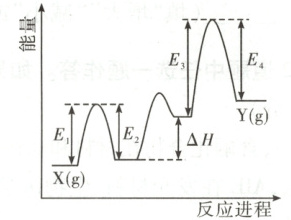
(1)催化剂Cr₂O₃可由(NH₄)₂Cr₂O₇加热分解制备,反应同时生成无污染气体。
①完成化学方程式:$(NH_{4})_{2}Cr_{2}O_{7}\xlongequal{\Delta}Cr_{2}O_{3}+$
②Cr₂O₃催化丙烷脱氢过程中,部分反应历程如图所示,X(g)→Y(g)过程的焓变为
③Cr₂O₃可用于NH₃的催化氧化。设计从NH₃出发经过3步反应制备HNO₃的路线
(2)K₂Cr₂O₇溶液中存在多个平衡。本题条件下仅需考虑如下平衡:
(ⅰ)$Cr_{2}O_{7}^{2-}(aq)+H_{2}O(l)\rightleftharpoons 2HCrO_{4}^{-}(aq)\quad K_{1}=3.0×10^{-2}(25\ ℃)$
(ⅱ)$HCrO_{4}^{-}(aq)\rightleftharpoons CrO_{4}^{2-}(aq)+H^{+}(aq)\quad K_{2}=3.3×10^{-7}(25\ ℃)$
①下列有关K₂Cr₂O₇溶液的说法正确的有
A.加入少量硫酸,溶液的pH不变
B.加入少量水稀释,溶液中离子总数增加
C.加入少量NaOH溶液,反应(ⅰ)的平衡逆向移动
D.加入少量K₂Cr₂O₇溶液,平衡时$c^{2}( HCrO_{4}^{-})$与$c( Cr_{2} O_{7}^{2-})$的比值保持不变
②25 ℃时,0.10 mol·L⁻¹ K₂Cr₂O₇溶液中$\lg\frac{c( CrO_{4}^{2-})}{c( Cr_{2} O_{7}^{2-})}$随pH的变化关系如图甲。当pH=9.00时,设Cr₂O₇²⁻、HCrO₄⁻与CrO₄²⁻的平衡浓度分别为x、y、z mol·L⁻¹,则x、y、z之间的关系式为
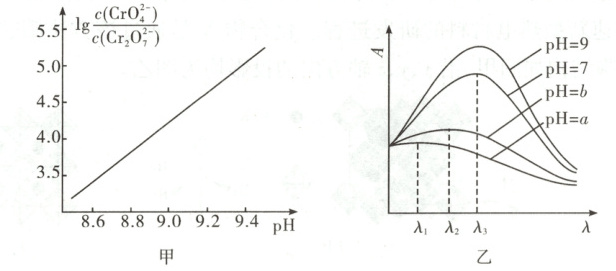
③在稀溶液中,一种物质对光的吸收程度(A)与其所吸收光的波长(λ)有关;在一定波长范围,最大A对应的波长(λₘₐₓ)取决于物质的结构特征;浓度越高,A越大。混合溶液在某一波长的A是各组分吸收程度之和。为研究pH对反应(ⅰ)和(ⅱ)平衡的影响,配制浓度相同、pH不同的K₂Cr₂O₇稀溶液,测得其A随λ的变化曲线如图乙。波长λ₁、λ₂和λ₃中,与CrO₄²⁻的λₘₐₓ最接近的是

(1)催化剂Cr₂O₃可由(NH₄)₂Cr₂O₇加热分解制备,反应同时生成无污染气体。
①完成化学方程式:$(NH_{4})_{2}Cr_{2}O_{7}\xlongequal{\Delta}Cr_{2}O_{3}+$
N₂↑
+4H₂O
。②Cr₂O₃催化丙烷脱氢过程中,部分反应历程如图所示,X(g)→Y(g)过程的焓变为
E₁ - E₂ + ΔH + E₃ - E₄
(列式表示)。③Cr₂O₃可用于NH₃的催化氧化。设计从NH₃出发经过3步反应制备HNO₃的路线
$NH₃ \xrightarrow[O_2]{Cr_2O_3} NO \xrightarrow[H_2O]{O_2} HNO₃$或$NH₃ \xrightarrow[O_2]{Cr_2O_3} NO \xrightarrow[H_2O]{O_2} HNO₃($任写其中一个)
(用“→”表示含氮物质间的转化);其中一个有颜色变化的反应的化学方程式为$2NO + O₂ \xlongequal{} 2NO₂$或$3NO₂ + H₂O \xlongequal{} 2HNO₃ + NO$或$4NO₂ + O₂ + 2H₂O \xlongequal{} 4HNO₃($任写其中一个)
。(2)K₂Cr₂O₇溶液中存在多个平衡。本题条件下仅需考虑如下平衡:
(ⅰ)$Cr_{2}O_{7}^{2-}(aq)+H_{2}O(l)\rightleftharpoons 2HCrO_{4}^{-}(aq)\quad K_{1}=3.0×10^{-2}(25\ ℃)$
(ⅱ)$HCrO_{4}^{-}(aq)\rightleftharpoons CrO_{4}^{2-}(aq)+H^{+}(aq)\quad K_{2}=3.3×10^{-7}(25\ ℃)$
①下列有关K₂Cr₂O₇溶液的说法正确的有
BD
。A.加入少量硫酸,溶液的pH不变
B.加入少量水稀释,溶液中离子总数增加
C.加入少量NaOH溶液,反应(ⅰ)的平衡逆向移动
D.加入少量K₂Cr₂O₇溶液,平衡时$c^{2}( HCrO_{4}^{-})$与$c( Cr_{2} O_{7}^{2-})$的比值保持不变
②25 ℃时,0.10 mol·L⁻¹ K₂Cr₂O₇溶液中$\lg\frac{c( CrO_{4}^{2-})}{c( Cr_{2} O_{7}^{2-})}$随pH的变化关系如图甲。当pH=9.00时,设Cr₂O₇²⁻、HCrO₄⁻与CrO₄²⁻的平衡浓度分别为x、y、z mol·L⁻¹,则x、y、z之间的关系式为
$x + \frac{1}{2}y + \frac{1}{2}z = 0.10$
=0.10;计算溶液中HCrO₄⁻的平衡浓度:由图可知,当溶液pH = 9.00时,$\frac{c(CrO_4^{2-})}{c(Cr_2O_7^{2-})} > 10⁴,$因此可忽略溶液中Cr₂O₇²⁻的浓度,即c(HCrO₄⁻) + c(CrO₄²⁻) = 0.20mol·L⁻¹,$K = \frac{c(CrO_4^{2-})·c(H^+)}{c(HCrO_4^-)} = 3.3×10⁻⁷,$pH = 9.00,c(H⁺) = 10⁻⁹mol·L⁻¹,$\frac{c(CrO_4^{2-})}{c(HCrO_4^-)} = 3.3×10²。$联立两个方程可得c(HCrO₄⁻)≈6.0×10⁻⁴mol·L⁻¹
(写出计算过程,结果保留两位有效数字)。
③在稀溶液中,一种物质对光的吸收程度(A)与其所吸收光的波长(λ)有关;在一定波长范围,最大A对应的波长(λₘₐₓ)取决于物质的结构特征;浓度越高,A越大。混合溶液在某一波长的A是各组分吸收程度之和。为研究pH对反应(ⅰ)和(ⅱ)平衡的影响,配制浓度相同、pH不同的K₂Cr₂O₇稀溶液,测得其A随λ的变化曲线如图乙。波长λ₁、λ₂和λ₃中,与CrO₄²⁻的λₘₐₓ最接近的是
λ₃
;溶液pH从a变到b的过程中,$\frac{c( H^{+})· c^{2}( CrO_{4}^{2-})}{c( Cr_{2} O_{7}^{2-})}$的值增大
(填“增大”“减小”或“不变”)。
答案:
19.参考答案
(1)①N₂↑ + 4H₂O
②E₁ - E₂ + ΔH + E₃ - E₄
$③NH₃ \xrightarrow[O_2]{Cr_2O_3} NO \xrightarrow[H_2O]{O_2} HNO₃$或$NH₃ \xrightarrow[O_2]{Cr_2O_3} NO \xrightarrow[H_2O]{O_2} HNO₃($任写其中一个)
$2NO + O₂ \xlongequal{} 2NO₂$或$3NO₂ + H₂O \xlongequal{} 2HNO₃ + NO$或$4NO₂ + O₂ + 2H₂O \xlongequal{} 4HNO₃($任写其中一个)
(2)①BD
$②x + \frac{1}{2}y + \frac{1}{2}z $由图可知,当溶液pH = 9.00时,$\frac{c(CrO_4^{2-})}{c(Cr_2O_7^{2-})} > 10⁴,$因此可忽略溶液中Cr₂O₇²⁻的浓度,即c(HCrO₄⁻) + c(CrO₄²⁻) = 0.20mol·L⁻¹,$K = \frac{c(CrO_4^{2-})·c(H^+)}{c(HCrO_4^-)} = 3.3×10⁻⁷,$pH = 9.00,c(H⁺) = 10⁻⁹mol·L⁻¹,$\frac{c(CrO_4^{2-})}{c(HCrO_4^-)} = 3.3×10²。$联立两个方程可得c(HCrO₄⁻)≈6.0×10⁻⁴mol·L⁻¹
③λ₃ 增大
(1)①N₂↑ + 4H₂O
②E₁ - E₂ + ΔH + E₃ - E₄
$③NH₃ \xrightarrow[O_2]{Cr_2O_3} NO \xrightarrow[H_2O]{O_2} HNO₃$或$NH₃ \xrightarrow[O_2]{Cr_2O_3} NO \xrightarrow[H_2O]{O_2} HNO₃($任写其中一个)
$2NO + O₂ \xlongequal{} 2NO₂$或$3NO₂ + H₂O \xlongequal{} 2HNO₃ + NO$或$4NO₂ + O₂ + 2H₂O \xlongequal{} 4HNO₃($任写其中一个)
(2)①BD
$②x + \frac{1}{2}y + \frac{1}{2}z $由图可知,当溶液pH = 9.00时,$\frac{c(CrO_4^{2-})}{c(Cr_2O_7^{2-})} > 10⁴,$因此可忽略溶液中Cr₂O₇²⁻的浓度,即c(HCrO₄⁻) + c(CrO₄²⁻) = 0.20mol·L⁻¹,$K = \frac{c(CrO_4^{2-})·c(H^+)}{c(HCrO_4^-)} = 3.3×10⁻⁷,$pH = 9.00,c(H⁺) = 10⁻⁹mol·L⁻¹,$\frac{c(CrO_4^{2-})}{c(HCrO_4^-)} = 3.3×10²。$联立两个方程可得c(HCrO₄⁻)≈6.0×10⁻⁴mol·L⁻¹
③λ₃ 增大
查看更多完整答案,请扫码查看


