2026年新高考5年真题高中化学全一册通用版广东专版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年新高考5年真题高中化学全一册通用版广东专版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第43页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
1. [2025·云南卷,4T,3分]$N_{\rm A}$为阿伏加德罗常数的值。下列说法正确的是 (
A.$22.4\ {\rm L\ CH_4}$中原子的数目为$5N_{\rm A}$
B.$1\ {\rm mol}\ ^{18}{\rm O}$所含中子的数目为$10N_{\rm A}$
C.$28\ {\rm g\ Fe}$粉和足量S 完全反应,转移电子的数目为$1.5N_{\rm A}$
D.$0.1\ {\rm L}\ 12\ {\rm mol· L^{-1}}$盐酸与足量${\rm MnO_2}$反应,生成${\rm Cl_2}$的数目为$0.3N_{\rm A}$
B
)A.$22.4\ {\rm L\ CH_4}$中原子的数目为$5N_{\rm A}$
B.$1\ {\rm mol}\ ^{18}{\rm O}$所含中子的数目为$10N_{\rm A}$
C.$28\ {\rm g\ Fe}$粉和足量S 完全反应,转移电子的数目为$1.5N_{\rm A}$
D.$0.1\ {\rm L}\ 12\ {\rm mol· L^{-1}}$盐酸与足量${\rm MnO_2}$反应,生成${\rm Cl_2}$的数目为$0.3N_{\rm A}$
答案:
1.参考答案B
命题意图本题通过阿伏加德罗常数的应用,考查气体摩尔体积、中子数计算等知识,体现了“宏观辨识与微观探析”等化学学科核心素养。
解题思路未指明气体是否处于标准状况,22.4LCH₄的物质的量无法确定,因此原子数目无法确定,A项错误。¹⁸O的中子数为18 - 8 = 10,1mol¹⁸O含10mol中子,数目为10Nₐ,B项正确。28g(0.5mol)Fe粉与足量S反应生成FeS,FeS中Fe的化合价为+2,转移电子为0.5mol×2 = 1mol,转移电子数为Nₐ,C项错误。浓盐酸与MnO₂反应的化学方程式为MnO₂ + 4HCl(浓$)\stackrel{△}{=}MnCl₂ + Cl₂↑ + 2H₂O,$随反应进行盐酸浓度变稀后,反应停止,实际生成Cl₂的物质的量小于0.3mol,Cl₂的数目小于0.3Nₐ,D项错误。
命题意图本题通过阿伏加德罗常数的应用,考查气体摩尔体积、中子数计算等知识,体现了“宏观辨识与微观探析”等化学学科核心素养。
解题思路未指明气体是否处于标准状况,22.4LCH₄的物质的量无法确定,因此原子数目无法确定,A项错误。¹⁸O的中子数为18 - 8 = 10,1mol¹⁸O含10mol中子,数目为10Nₐ,B项正确。28g(0.5mol)Fe粉与足量S反应生成FeS,FeS中Fe的化合价为+2,转移电子为0.5mol×2 = 1mol,转移电子数为Nₐ,C项错误。浓盐酸与MnO₂反应的化学方程式为MnO₂ + 4HCl(浓$)\stackrel{△}{=}MnCl₂ + Cl₂↑ + 2H₂O,$随反应进行盐酸浓度变稀后,反应停止,实际生成Cl₂的物质的量小于0.3mol,Cl₂的数目小于0.3Nₐ,D项错误。
2. [2025·黑龙江卷,4T,3分]钠及其化合物的部分转化关系如图。设$N_{\rm A}$为阿伏加德罗常数的值,下列说法正确的是 (
$\rm{NaCl\ \xrightarrow{①\ 电解}\ Na\ \xrightarrow{②\ O_2}\ Na_2O_2\ \xrightarrow{③\ H_2O}\ NaOH\ \xrightarrow{④\ Cl_2}\ NaClO}$
A.反应①生成的气体,每$11.2\ {\rm L}$(标准状况)含原子的数目为$N_{\rm A}$
B.反应②中$2.3\ {\rm g\ Na}$完全反应生成的产物中含非极性键的数目为$0.1N_{\rm A}$
C.反应③中$1\ {\rm mol\ Na_2O_2}$与足量${\rm H_2O}$反应转移电子的数目为$2N_{\rm A}$
D.$100\ {\rm mL}\ 1\ {\rm mol· L^{-1}\ NaClO}$溶液中,${\rm ClO^-}$的数目为$0.1N_{\rm A}$
A
)$\rm{NaCl\ \xrightarrow{①\ 电解}\ Na\ \xrightarrow{②\ O_2}\ Na_2O_2\ \xrightarrow{③\ H_2O}\ NaOH\ \xrightarrow{④\ Cl_2}\ NaClO}$
A.反应①生成的气体,每$11.2\ {\rm L}$(标准状况)含原子的数目为$N_{\rm A}$
B.反应②中$2.3\ {\rm g\ Na}$完全反应生成的产物中含非极性键的数目为$0.1N_{\rm A}$
C.反应③中$1\ {\rm mol\ Na_2O_2}$与足量${\rm H_2O}$反应转移电子的数目为$2N_{\rm A}$
D.$100\ {\rm mL}\ 1\ {\rm mol· L^{-1}\ NaClO}$溶液中,${\rm ClO^-}$的数目为$0.1N_{\rm A}$
答案:
2.参考答案A
命题意图本题以钠及其化合物的转化关系为情境,考查阿伏加德罗常数的有关计算,涉及微粒数目、化学键、氧化还原反应等知识,体现了“宏观辨识与微观探析”等化学学科核心素养。
解题思路反应①的化学方程式为2NaCl(熔融$)\stackrel{电解}{=}2Na + Cl₂↑,$标准状况下11.2LCl₂为0.5mol,含氯原子的数目为0.5mol×2×Nₐmol⁻¹ = Nₐ,A项正确。2.3g(0.1mol)Na与氧气加热反应生成0.05molNa₂O₂,Na₂O₂的电子式为Na⁺[:Ö:Ö:]²⁻Na⁺,所以其中非极性键(O—O)数目为0.05Nₐ,B项错误。Na₂O₂与水反应的化学方程式为2Na₂O₂ + 2H₂O = 4NaOH + O₂↑,2Na₂O₂∼2e⁻,则1molNa₂O₂与足量水反应转移电子的数目为Nₐ,C项错误。ClO⁻在水中会水解,则100mL1mol·L⁻¹NaClO溶液中ClO⁻的数目小于0.1Nₐ,D项错误。
命题意图本题以钠及其化合物的转化关系为情境,考查阿伏加德罗常数的有关计算,涉及微粒数目、化学键、氧化还原反应等知识,体现了“宏观辨识与微观探析”等化学学科核心素养。
解题思路反应①的化学方程式为2NaCl(熔融$)\stackrel{电解}{=}2Na + Cl₂↑,$标准状况下11.2LCl₂为0.5mol,含氯原子的数目为0.5mol×2×Nₐmol⁻¹ = Nₐ,A项正确。2.3g(0.1mol)Na与氧气加热反应生成0.05molNa₂O₂,Na₂O₂的电子式为Na⁺[:Ö:Ö:]²⁻Na⁺,所以其中非极性键(O—O)数目为0.05Nₐ,B项错误。Na₂O₂与水反应的化学方程式为2Na₂O₂ + 2H₂O = 4NaOH + O₂↑,2Na₂O₂∼2e⁻,则1molNa₂O₂与足量水反应转移电子的数目为Nₐ,C项错误。ClO⁻在水中会水解,则100mL1mol·L⁻¹NaClO溶液中ClO⁻的数目小于0.1Nₐ,D项错误。
3. [2025·河北卷,4T,3分]设$N_{\rm A}$是阿伏加德罗常数的值,下列说法错误的是 (
A.$18\ {\rm g\ H_2O}$晶体内氢键的数目为$2N_{\rm A}$
B.$1\ {\rm L}\ 1\ {\rm mol· L^{-1}}$的${\rm NaF}$溶液中阳离子总数为$N_{\rm A}$
C.$28\ {\rm g}$环己烷和戊烯的混合物中碳原子的数目为$2N_{\rm A}$
D.铅酸蓄电池负极增重$96\ {\rm g}$,理论上转移电子数为$2N_{\rm A}$
B
)A.$18\ {\rm g\ H_2O}$晶体内氢键的数目为$2N_{\rm A}$
B.$1\ {\rm L}\ 1\ {\rm mol· L^{-1}}$的${\rm NaF}$溶液中阳离子总数为$N_{\rm A}$
C.$28\ {\rm g}$环己烷和戊烯的混合物中碳原子的数目为$2N_{\rm A}$
D.铅酸蓄电池负极增重$96\ {\rm g}$,理论上转移电子数为$2N_{\rm A}$
答案:
3.参考答案B
命题意图本题结合阿伏加德罗常数,涉及氢键、微粒数目及铅酸蓄电池等知识,体现了“宏观辨识与微观探析”“证据推理与模型认知”等化学学科核心素养。
解题思路18gH₂O的物质的量为1molH₂O,1个H₂O分子平均能形成2个氢键,则18gH₂O晶体内氢键数目为2Nₐ,A项正确。1L1mol·L⁻¹的NaF溶液中阳离子有Na⁺、H⁺(由水电离产生),则阳离子总数大于Nₐ,B项错误。环己烷与戊烯的最简式均为CH₂,则28g混合物中碳原子的数目为$1×\frac{28g}{(12 + 2)g·mol⁻¹}×Nₐmol⁻¹ = 2Nₐ,$C项正确。放电时,铅酸蓄电池负极的电极反应为Pb + SO₄²⁻ - 2e⁻ = PbSO₄,电池负极增加的质量即消耗SO₄²⁻的质量,n消耗$(SO₄²⁻) = \frac{96g}{96g·mol⁻¹} = 1mol,$根据SO₄²⁻∼2e⁻可知,消耗1molSO₄²⁻时,理论上转移电子数为2Nₐ,D项正确。
追根溯源

如图所示,冰(H₂O晶体)中一个水分子只能与周围4个紧邻的水分子形成氢键,每个氢原子形成一个氢键,则每摩尔冰有2Nₐ个氢键(Nₐ为阿伏加德罗常数的值)。
3.参考答案B
命题意图本题结合阿伏加德罗常数,涉及氢键、微粒数目及铅酸蓄电池等知识,体现了“宏观辨识与微观探析”“证据推理与模型认知”等化学学科核心素养。
解题思路18gH₂O的物质的量为1molH₂O,1个H₂O分子平均能形成2个氢键,则18gH₂O晶体内氢键数目为2Nₐ,A项正确。1L1mol·L⁻¹的NaF溶液中阳离子有Na⁺、H⁺(由水电离产生),则阳离子总数大于Nₐ,B项错误。环己烷与戊烯的最简式均为CH₂,则28g混合物中碳原子的数目为$1×\frac{28g}{(12 + 2)g·mol⁻¹}×Nₐmol⁻¹ = 2Nₐ,$C项正确。放电时,铅酸蓄电池负极的电极反应为Pb + SO₄²⁻ - 2e⁻ = PbSO₄,电池负极增加的质量即消耗SO₄²⁻的质量,n消耗$(SO₄²⁻) = \frac{96g}{96g·mol⁻¹} = 1mol,$根据SO₄²⁻∼2e⁻可知,消耗1molSO₄²⁻时,理论上转移电子数为2Nₐ,D项正确。
追根溯源

如图所示,冰(H₂O晶体)中一个水分子只能与周围4个紧邻的水分子形成氢键,每个氢原子形成一个氢键,则每摩尔冰有2Nₐ个氢键(Nₐ为阿伏加德罗常数的值)。
4. [2024·吉林卷,4T,3分]硫及其化合物部分转化关系如图。设$N_{\rm A}$为阿伏加德罗常数的值,下列说法正确的是 (
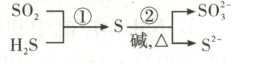
A.标准状况下,$11.2\ {\rm L\ SO_2}$中原子总数为$0.5N_{\rm A}$
B.$100\ {\rm mL}\ 0.1\ {\rm mol· L^{-1}\ Na_2SO_3}$溶液中,${\rm SO_3^{2-}}$数目为$0.01N_{\rm A}$
C.反应①每消耗$3.4\ {\rm g\ H_2S}$,生成物中硫原子数目为$0.1N_{\rm A}$
D.反应②每生成$1\ {\rm mol}$还原产物,转移电子数目为$2N_{\rm A}$
D
)
A.标准状况下,$11.2\ {\rm L\ SO_2}$中原子总数为$0.5N_{\rm A}$
B.$100\ {\rm mL}\ 0.1\ {\rm mol· L^{-1}\ Na_2SO_3}$溶液中,${\rm SO_3^{2-}}$数目为$0.01N_{\rm A}$
C.反应①每消耗$3.4\ {\rm g\ H_2S}$,生成物中硫原子数目为$0.1N_{\rm A}$
D.反应②每生成$1\ {\rm mol}$还原产物,转移电子数目为$2N_{\rm A}$
答案:
4.参考答案D
命题意图本题以硫及其化合物部分转化关系为素材考查阿伏加德罗常数,涉及粒子个数、氧化还原反应等知识,体现了“宏观辨识与微观探析”“证据推理与模型认知”化学学科核心素养。
解题思路1个SO₂中含有3个原子,标准状况下,11.2LSO₂中原子总数为$\frac{11.2L}{22.4L·mol⁻¹}×3×Nₐmol⁻¹ = 1.5Nₐ,$A项错误。SO₃²⁻在水溶液中会发生水解,则100mL0.1mol·L⁻¹Na₂SO₃溶液中,SO₃²⁻的物质的量小于0.1mol·L⁻¹×0.1L = 0.01mol,即SO₃²⁻数目小于0.01Nₐ,B项错误。反应①为SO₂ + 2H₂S = 3S↓ + 2H₂O,每消耗3.4g(0.1mol)H₂S,生成0.15molS单质,即生成物中硫原子数目为0.15Nₐ,C项错误。反应②为$3S + 6OH⁻\stackrel{△}{=}SO₃²⁻ + 2S²⁻ + 3H₂O,$还原产物是S²⁻,根据离子方程式可知,2S²⁻∼4e⁻,即每生成1molS²⁻,转移电子数为2Nₐ,D项正确。
命题意图本题以硫及其化合物部分转化关系为素材考查阿伏加德罗常数,涉及粒子个数、氧化还原反应等知识,体现了“宏观辨识与微观探析”“证据推理与模型认知”化学学科核心素养。
解题思路1个SO₂中含有3个原子,标准状况下,11.2LSO₂中原子总数为$\frac{11.2L}{22.4L·mol⁻¹}×3×Nₐmol⁻¹ = 1.5Nₐ,$A项错误。SO₃²⁻在水溶液中会发生水解,则100mL0.1mol·L⁻¹Na₂SO₃溶液中,SO₃²⁻的物质的量小于0.1mol·L⁻¹×0.1L = 0.01mol,即SO₃²⁻数目小于0.01Nₐ,B项错误。反应①为SO₂ + 2H₂S = 3S↓ + 2H₂O,每消耗3.4g(0.1mol)H₂S,生成0.15molS单质,即生成物中硫原子数目为0.15Nₐ,C项错误。反应②为$3S + 6OH⁻\stackrel{△}{=}SO₃²⁻ + 2S²⁻ + 3H₂O,$还原产物是S²⁻,根据离子方程式可知,2S²⁻∼4e⁻,即每生成1molS²⁻,转移电子数为2Nₐ,D项正确。
5. [2024·贵州卷,6T,3分]二氧化氯(${\rm ClO_2}$)可用于自来水消毒。实验室用草酸(${\rm H_2C_2O_4}$)和${\rm KClO_3}$制取${\rm ClO_2}$的反应为${\rm H_2C_2O_4 + 2KClO_3 + H_2SO_4 \xlongequal\ 2ClO_2\uparrow + 2CO_2\uparrow + K_2SO_4 + 2H_2O}$。设$N_{\rm A}$为阿伏加德罗常数的值。下列说法正确的是 (
A.$0.1\ {\rm mol\ H_2^{18}O}$中含有的中子数为$1.2N_{\rm A}$
B.每生成$67.5\ {\rm g\ ClO_2}$,转移电子数为$2.0N_{\rm A}$
C.$0.1\ {\rm mol· L^{-1}\ H_2C_2O_4}$溶液中含有的${\rm H^+}$数目为$0.2N_{\rm A}$
D.标准状况下,$22.4\ {\rm L\ CO_2}$中含$\sigma$键数目为$2.0N_{\rm A}$
D
)A.$0.1\ {\rm mol\ H_2^{18}O}$中含有的中子数为$1.2N_{\rm A}$
B.每生成$67.5\ {\rm g\ ClO_2}$,转移电子数为$2.0N_{\rm A}$
C.$0.1\ {\rm mol· L^{-1}\ H_2C_2O_4}$溶液中含有的${\rm H^+}$数目为$0.2N_{\rm A}$
D.标准状况下,$22.4\ {\rm L\ CO_2}$中含$\sigma$键数目为$2.0N_{\rm A}$
答案:
5.参考答案D
命题意图本题以实验室制取ClO₂的反应为素材,考查阿伏加德罗常数,意在考查考生的理解分析能力,体现了“宏观辨识与微观探析”化学学科核心素养。
解题思路1个H₂¹⁸O中含有10个中子,故0.1molH₂¹⁸O中含有的中子数为1.0Nₐ,A项错误。67.5gClO₂的物质的量为1mol,由题给化学方程式知,KClO₃∼ClO₂∼e⁻,每生成1molClO₂转移电子数为1.0Nₐ,B项错误。H₂C₂O₄为弱酸,在水中不能完全电离,且溶液体积未知,无法计算H⁺数目,C项错误。标准状况下,22.4LCO₂的物质的量为1mol,CO₂的结构式为O = C = O,双键中含1个σ键和1个π键,故1molCO₂含有σ键数目为2.0Nₐ,D项正确。
命题意图本题以实验室制取ClO₂的反应为素材,考查阿伏加德罗常数,意在考查考生的理解分析能力,体现了“宏观辨识与微观探析”化学学科核心素养。
解题思路1个H₂¹⁸O中含有10个中子,故0.1molH₂¹⁸O中含有的中子数为1.0Nₐ,A项错误。67.5gClO₂的物质的量为1mol,由题给化学方程式知,KClO₃∼ClO₂∼e⁻,每生成1molClO₂转移电子数为1.0Nₐ,B项错误。H₂C₂O₄为弱酸,在水中不能完全电离,且溶液体积未知,无法计算H⁺数目,C项错误。标准状况下,22.4LCO₂的物质的量为1mol,CO₂的结构式为O = C = O,双键中含1个σ键和1个π键,故1molCO₂含有σ键数目为2.0Nₐ,D项正确。
6. [2024·河北卷,4T,3分]超氧化钾(${\rm KO_2}$)可用作潜水或宇航装置的${\rm CO_2}$吸收剂和供氧剂,反应为$4{\rm KO_2 + 2CO_2 \xlongequal\ 2K_2CO_3 + 3O_2}$。$N_{\rm A}$为阿伏加德罗常数的值。下列说法正确的是 (
A.$44\ {\rm g\ CO_2}$中$\sigma$键的数目为$2N_{\rm A}$
B.$1\ {\rm mol\ KO_2}$晶体中离子的数目为$3N_{\rm A}$
C.$1\ {\rm L}\ 1\ {\rm mol· L^{-1}\ K_2CO_3}$溶液中${\rm CO_3^{2-}}$的数目为$N_{\rm A}$
D.该反应中每转移$1\ {\rm mol}$电子生成${\rm O_2}$的数目为$1.5N_{\rm A}$
A
)A.$44\ {\rm g\ CO_2}$中$\sigma$键的数目为$2N_{\rm A}$
B.$1\ {\rm mol\ KO_2}$晶体中离子的数目为$3N_{\rm A}$
C.$1\ {\rm L}\ 1\ {\rm mol· L^{-1}\ K_2CO_3}$溶液中${\rm CO_3^{2-}}$的数目为$N_{\rm A}$
D.该反应中每转移$1\ {\rm mol}$电子生成${\rm O_2}$的数目为$1.5N_{\rm A}$
答案:
6.参考答案A
命题意图本题考查阿伏加德罗常数,涉及σ键数目、弱酸根离子的水解、氧化还原反应中的转移电子数等知识,意在考查考生对基础知识的掌握能力,体现了“宏观辨识与微观探析”化学学科核心素养。
解题思路CO₂的结构式为O = C = O,C = O中含1个σ键、1个π键,44g(1mol)CO₂中σ键的数目为2Nₐ,A项正确。KO₂晶体中含有的离子为K⁺、O₂⁻,故1molKO₂晶体中离子的数目为2Nₐ,B项错误。该溶液中K₂CO₃的物质的量为1mol,由于CO₃²⁻在溶液中发生水解反应,故溶液中CO₃²⁻的数目小于Nₐ,C项错误。根据题给反应可知,KO₂→O₂,O的化合价由$ - \frac{1}{2}$升高为0,故存在关系式O₂∼e⁻,则转移1mol电子时,生成1molO₂,即生成O₂的数目为Nₐ,D项错误。
命题意图本题考查阿伏加德罗常数,涉及σ键数目、弱酸根离子的水解、氧化还原反应中的转移电子数等知识,意在考查考生对基础知识的掌握能力,体现了“宏观辨识与微观探析”化学学科核心素养。
解题思路CO₂的结构式为O = C = O,C = O中含1个σ键、1个π键,44g(1mol)CO₂中σ键的数目为2Nₐ,A项正确。KO₂晶体中含有的离子为K⁺、O₂⁻,故1molKO₂晶体中离子的数目为2Nₐ,B项错误。该溶液中K₂CO₃的物质的量为1mol,由于CO₃²⁻在溶液中发生水解反应,故溶液中CO₃²⁻的数目小于Nₐ,C项错误。根据题给反应可知,KO₂→O₂,O的化合价由$ - \frac{1}{2}$升高为0,故存在关系式O₂∼e⁻,则转移1mol电子时,生成1molO₂,即生成O₂的数目为Nₐ,D项错误。
查看更多完整答案,请扫码查看


