2026年新高考5年真题高中化学全一册通用版广东专版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年新高考5年真题高中化学全一册通用版广东专版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第4页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
16. 某理论研究认为:燃料电池(图乙)的电极Ⅰ和Ⅱ上所发生反应的催化机理示意图分别如图甲和图丙,其中$\mathrm{O_2}$获得第一个电子的过程最慢。由此可知,理论上 (
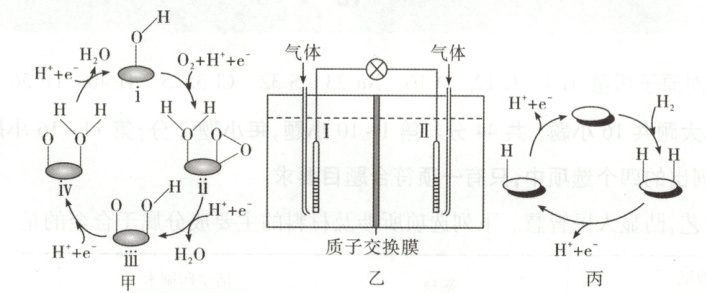
A.负极反应的催化剂是i
B.图甲中,i到ii过程的活化能一定最低
C.电池工作过程中,负极室的溶液质量保持不变
D.相同时间内,电极Ⅰ和电极Ⅱ上的催化循环完成次数相同
C
)
A.负极反应的催化剂是i
B.图甲中,i到ii过程的活化能一定最低
C.电池工作过程中,负极室的溶液质量保持不变
D.相同时间内,电极Ⅰ和电极Ⅱ上的催化循环完成次数相同
答案:
16.参考答案C
命题意图本题以燃料电池催化机理研究为情境,意在考查考生读图能力和理解分析能力,体现了“证据推理与模型认知”“科学探究与创新意识”等化学学科核心素养。
解题思路该燃料电池为氢氧燃料电池,由图可知,电极Ⅱ上H₂发生氧化反应,电极Ⅱ为负极,电极反应为H₂ - 2e⁻=2H⁺;电极Ⅰ上O₂发生还原反应,电极Ⅰ为正极,电极反应为O₂+4e⁻+4H⁺=2H₂O。由图甲可知,正反应的催化剂是i,A项错误。图甲中,i到ii过程为O₂获得第一个电子的过程,根据题意可知,O₂获得第一个电子的过程最慢,则i到ii过程的活化能最高,B项错误。根据负极的电极反应,为保持溶液呈电中性,H⁺通过质子交换膜进入正极室,故电池工作过程中,负极室的溶液质量不变,C项正确。由电极反应可知,O₂催化循环一次转移4个电子,H₂催化循环一次转移2个电子,相同时间内两电极转移电子量相同,则电极Ⅰ和电极Ⅱ上的催化循环完成次数不相同,D项错误。
命题意图本题以燃料电池催化机理研究为情境,意在考查考生读图能力和理解分析能力,体现了“证据推理与模型认知”“科学探究与创新意识”等化学学科核心素养。
解题思路该燃料电池为氢氧燃料电池,由图可知,电极Ⅱ上H₂发生氧化反应,电极Ⅱ为负极,电极反应为H₂ - 2e⁻=2H⁺;电极Ⅰ上O₂发生还原反应,电极Ⅰ为正极,电极反应为O₂+4e⁻+4H⁺=2H₂O。由图甲可知,正反应的催化剂是i,A项错误。图甲中,i到ii过程为O₂获得第一个电子的过程,根据题意可知,O₂获得第一个电子的过程最慢,则i到ii过程的活化能最高,B项错误。根据负极的电极反应,为保持溶液呈电中性,H⁺通过质子交换膜进入正极室,故电池工作过程中,负极室的溶液质量不变,C项正确。由电极反应可知,O₂催化循环一次转移4个电子,H₂催化循环一次转移2个电子,相同时间内两电极转移电子量相同,则电极Ⅰ和电极Ⅱ上的催化循环完成次数不相同,D项错误。
17. (14分)酸及盐在生活生产中应用广泛。
(1) 甲苯氧化可生成苯甲酸。向盛有2 mL甲苯的试管中,加入几滴酸性$\mathrm{KMnO_4}$溶液,振荡,观察到体系颜色
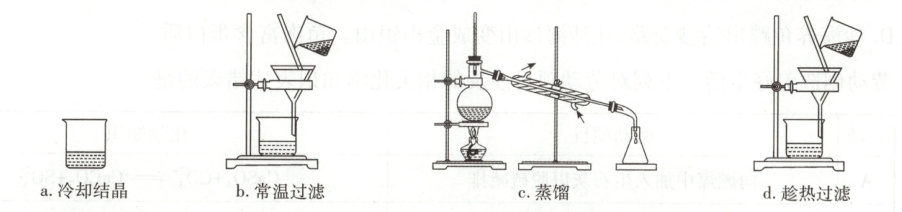
(2) 某苯甲酸粗品含少量泥沙和氯化钠。用重结晶法提纯该粗品过程中,需要的操作及其顺序为:加热溶解、
(3) 兴趣小组测定常温下苯甲酸饱和溶液的浓度$c_0$和苯甲酸的$K_a$,实验如下:取50.00 mL苯甲酸饱和溶液,用0.1000 mol·L⁻¹$\mathrm{NaOH}$溶液滴定,用pH计测得体系的pH随滴入溶液体积V变化的曲线如图。据图可得:
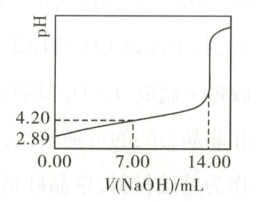
①$c_0 =$
②苯甲酸的$K_a =$
(4) 该小组继续探究取代基对芳香酸酸性的影响。
①知识回顾 羧酸酸性可用$K_a$衡量。下列羧酸$K_a$的变化顺序为:$\mathrm{CH_3COOH < CH_2ClCOOH < CCl_3COOH < CF_3COOH}$。
随着卤原子电负性
②提出假设 甲同学根据①中规律推测下列芳香酸的酸性强弱顺序为:
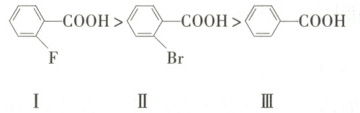
③验证假设 甲同学测得常温下三种酸的饱和溶液的pH大小顺序为Ⅲ>Ⅱ>Ⅰ,据此推断假设成立。但乙同学认为该推断依据不足,不能用所测得的pH直接判断$K_a$大小顺序,因为
乙同学用(3)中方法测定了上述三种酸的$K_a$,其顺序为Ⅱ>Ⅰ>Ⅲ。
④实验小结 假设不成立,芳香环上取代基效应较复杂,①中规律不可随意推广。
(5) 该小组尝试测弱酸$\mathrm{HClO}$的$K_a$。
①丙同学认为不宜按照(3)中方法进行实验,其原因之一是次氯酸易分解。该分解反应的离子方程式为
②小组讨论后,选用0.100 mol·L⁻¹$\mathrm{NaClO}$溶液(含少量$\mathrm{NaCl}$)进行实验,以获得$\mathrm{HClO}$的$K_a$。简述该方案
③教师指导:设计实验方案时,需要根据物质性质,具体问题具体分析。
(1) 甲苯氧化可生成苯甲酸。向盛有2 mL甲苯的试管中,加入几滴酸性$\mathrm{KMnO_4}$溶液,振荡,观察到体系颜色
由紫色逐渐变浅消失
。(2) 某苯甲酸粗品含少量泥沙和氯化钠。用重结晶法提纯该粗品过程中,需要的操作及其顺序为:加热溶解、
d、a、b
(填下列操作编号)。
(3) 兴趣小组测定常温下苯甲酸饱和溶液的浓度$c_0$和苯甲酸的$K_a$,实验如下:取50.00 mL苯甲酸饱和溶液,用0.1000 mol·L⁻¹$\mathrm{NaOH}$溶液滴定,用pH计测得体系的pH随滴入溶液体积V变化的曲线如图。据图可得:

①$c_0 =$
0.0280
mol·L⁻¹。②苯甲酸的$K_a =$
$\frac{10^{-2.89}×10^{-2.89}}{0.0280 - 10^{-2.89}}$
(列出算式,水的电离可忽略)。(4) 该小组继续探究取代基对芳香酸酸性的影响。
①知识回顾 羧酸酸性可用$K_a$衡量。下列羧酸$K_a$的变化顺序为:$\mathrm{CH_3COOH < CH_2ClCOOH < CCl_3COOH < CF_3COOH}$。
随着卤原子电负性
增大
,羧基中的羟基极性
增大,酸性增强。②提出假设 甲同学根据①中规律推测下列芳香酸的酸性强弱顺序为:

③验证假设 甲同学测得常温下三种酸的饱和溶液的pH大小顺序为Ⅲ>Ⅱ>Ⅰ,据此推断假设成立。但乙同学认为该推断依据不足,不能用所测得的pH直接判断$K_a$大小顺序,因为
常温下三种酸的饱和溶液的浓度不完全相同
。乙同学用(3)中方法测定了上述三种酸的$K_a$,其顺序为Ⅱ>Ⅰ>Ⅲ。
④实验小结 假设不成立,芳香环上取代基效应较复杂,①中规律不可随意推广。
(5) 该小组尝试测弱酸$\mathrm{HClO}$的$K_a$。
①丙同学认为不宜按照(3)中方法进行实验,其原因之一是次氯酸易分解。该分解反应的离子方程式为
$2HClO\xlongequal{光照}2H⁺+2Cl⁻+O₂↑$
。②小组讨论后,选用0.100 mol·L⁻¹$\mathrm{NaClO}$溶液(含少量$\mathrm{NaCl}$)进行实验,以获得$\mathrm{HClO}$的$K_a$。简述该方案
取适量0.100mol·L⁻¹NaClO溶液放入烧杯中,用pH计测得体系在25℃下的pH,记录数据。根据$K_b=\frac{c(HClO)·c(OH⁻)}{c(ClO⁻)}≈\frac{c²(OH⁻)}{0.100}=\frac{(10^{pH - 14})²}{0.100}$计算ClO⁻的水解平衡常数K_b,再利用公式$K_a=\frac{K_w}{K_b}=10^{13 - 2pH}$求出HClO的K_a。
(包括所用仪器及数据处理思路)。③教师指导:设计实验方案时,需要根据物质性质,具体问题具体分析。
答案:
17.参考答案
(1)由紫色逐渐变浅消失
(2)d、a、b
$(3)①0.0280 ②\frac{10^{-2.89}×10^{-2.89}}{0.0280 - 10^{-2.89}}$
(4)①增大极性 ③常温下三种酸的饱和溶液的浓度不完全相同
$(5)①2HClO\xlongequal{光照}2H⁺+2Cl⁻+O₂↑ ②$取适量0.100mol·L⁻¹NaClO溶液放入烧杯中,用pH计测得体系在25℃下的pH,记录数据。根据$K_b=\frac{c(HClO)·c(OH⁻)}{c(ClO⁻)}≈\frac{c²(OH⁻)}{0.100}=\frac{(10^{pH - 14})²}{0.100}$计算ClO⁻的水解平衡常数K_b,再利用公式$K_a=\frac{K_w}{K_b}=10^{13 - 2pH}$求出HClO的K_a。
命题意图本题以酸及盐的应用为主线,涉及重结晶、酸碱滴定、取代基对酸性的影响、电离平衡常数测定等知识,体现了“科学探究与创新意识”“证据推理与模型认知”等化学学科核心素养。
解题思路
(1)酸性KMnO₄溶液具有强氧化性,可以将甲苯氧化生成苯甲酸,故向盛有2mL甲苯的试管中,加入几滴酸性KMnO₄溶液,振荡,观察到体系颜色由紫色逐渐变浅消失。
(2)用重结晶法提纯苯甲酸粗品过程中,需要依次进行的操作为加热溶解、趁热过滤(除去不溶性杂质,防止降温使苯甲酸提前析出)、冷却结晶、常温过滤。
(3)①由图像可知,当加入14.00mLNaOH溶液时,苯甲酸恰好被完全中和,则苯甲酸饱和溶液的浓度$c₀=\frac{0.1000mol·L⁻¹×14.00×10⁻³L}{50.00×10⁻³L}=0.0280mol·L⁻¹。$②由图像可知,初始苯甲酸饱和溶液的pH为2.89,忽略水的电离,则苯甲酸饱和溶液中的c(H⁺)=c(苯甲酸根)=10⁻².⁸⁹mol·L⁻¹,则苯甲酸的$K_a=\frac{10^{-2.89}×10^{-2.89}}{0.0280 - 10^{-2.89}}。$
(4)①羧酸酸性的强弱取决于羧基中O—H键的极性大小,极性越大,酸性越强,卤素原子的电负性越大,吸电子能力越强,使得羧基中O—H键的极性越大,越易电离出H⁺,酸性越强。②羧酸中烃基越长,推电子效应越大,羧基中羟基的极性更小,越不容易电离出H⁺,酸性更弱。
易错归纳
键的极性对羧酸酸性的影响
①羧酸中卤原子电负性越大,羧基中羟基的极性更大,更容易电离出H⁺,酸性更强。②羧酸中烃基越长,推电子效应越大,羧基中羟基的极性更小,越不容易电离出H⁺,酸性更弱。
(1)由紫色逐渐变浅消失
(2)d、a、b
$(3)①0.0280 ②\frac{10^{-2.89}×10^{-2.89}}{0.0280 - 10^{-2.89}}$
(4)①增大极性 ③常温下三种酸的饱和溶液的浓度不完全相同
$(5)①2HClO\xlongequal{光照}2H⁺+2Cl⁻+O₂↑ ②$取适量0.100mol·L⁻¹NaClO溶液放入烧杯中,用pH计测得体系在25℃下的pH,记录数据。根据$K_b=\frac{c(HClO)·c(OH⁻)}{c(ClO⁻)}≈\frac{c²(OH⁻)}{0.100}=\frac{(10^{pH - 14})²}{0.100}$计算ClO⁻的水解平衡常数K_b,再利用公式$K_a=\frac{K_w}{K_b}=10^{13 - 2pH}$求出HClO的K_a。
命题意图本题以酸及盐的应用为主线,涉及重结晶、酸碱滴定、取代基对酸性的影响、电离平衡常数测定等知识,体现了“科学探究与创新意识”“证据推理与模型认知”等化学学科核心素养。
解题思路
(1)酸性KMnO₄溶液具有强氧化性,可以将甲苯氧化生成苯甲酸,故向盛有2mL甲苯的试管中,加入几滴酸性KMnO₄溶液,振荡,观察到体系颜色由紫色逐渐变浅消失。
(2)用重结晶法提纯苯甲酸粗品过程中,需要依次进行的操作为加热溶解、趁热过滤(除去不溶性杂质,防止降温使苯甲酸提前析出)、冷却结晶、常温过滤。
(3)①由图像可知,当加入14.00mLNaOH溶液时,苯甲酸恰好被完全中和,则苯甲酸饱和溶液的浓度$c₀=\frac{0.1000mol·L⁻¹×14.00×10⁻³L}{50.00×10⁻³L}=0.0280mol·L⁻¹。$②由图像可知,初始苯甲酸饱和溶液的pH为2.89,忽略水的电离,则苯甲酸饱和溶液中的c(H⁺)=c(苯甲酸根)=10⁻².⁸⁹mol·L⁻¹,则苯甲酸的$K_a=\frac{10^{-2.89}×10^{-2.89}}{0.0280 - 10^{-2.89}}。$
(4)①羧酸酸性的强弱取决于羧基中O—H键的极性大小,极性越大,酸性越强,卤素原子的电负性越大,吸电子能力越强,使得羧基中O—H键的极性越大,越易电离出H⁺,酸性越强。②羧酸中烃基越长,推电子效应越大,羧基中羟基的极性更小,越不容易电离出H⁺,酸性更弱。
易错归纳
键的极性对羧酸酸性的影响
①羧酸中卤原子电负性越大,羧基中羟基的极性更大,更容易电离出H⁺,酸性更强。②羧酸中烃基越长,推电子效应越大,羧基中羟基的极性更小,越不容易电离出H⁺,酸性更弱。
查看更多完整答案,请扫码查看


