2026年新高考5年真题高中化学全一册通用版广东专版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年新高考5年真题高中化学全一册通用版广东专版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第75页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
4. [2024·贵州卷,16T,15分] 煤气化渣属于大宗固废,主要成分为 $ Fe_2 O_3$、$ Al_2 O_3$、$ SiO_2$ 及少量 $ MgO$ 等。一种利用“酸浸—碱沉—充钠”工艺,制备钠基正极材料 $ NaFePO_4$ 和回收 $ Al_2 O_3$ 的流程如下:

已知:
ⅰ $25° C$ 时,$K_ sp[ Fe(OH)_3] = 2.8 × 10^{-39}$,$K_ sp[ Al(OH)_3] = 1.3 × 10^{-33}$,$K_ sp[ Mg(OH)_2] = 5.6 × 10^{-12}$;
ⅱ $2 Na[Al(OH)_4]( aq) \stackrel{ 加热}{\longrightarrow} Al_2 O_3 · 3 H_2 O(s) + 2 NaOH(aq)$。
回答下列问题:
(1) “滤渣”的主要成分为
(2) $25° C$ 时,“碱沉”控制溶液 pH 至 3.0,此时溶液中 $c( Fe^{3+}) =$
(3) “除杂”时需加入的试剂 X 是
(4) “水热合成”中,$ NH_4 H_2 PO_4$ 作为磷源,“滤液 2”的作用是
(5) “煅烧”得到的物质也能合成钠基正极材料 $ NaFeO_2$,其工艺如下:

① 该工艺经碳热还原得到 $ Fe_3 O_4$,“煅烧”生成 $ NaFeO_2$ 的化学方程式为
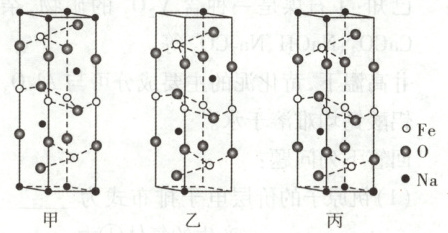
② $ NaFeO_2$ 的晶胞结构示意图如甲所示。每个晶胞中含有 $ NaFeO_2$ 的单元数有
③ 若“煅烧”温度为 $700° C$,$n( Na_2 CO_3):n( Fe_3 O_4) = 9:8$ 时,生成纯相 $ Na_{1-x} FeO_2$,则 $x =$

已知:
ⅰ $25° C$ 时,$K_ sp[ Fe(OH)_3] = 2.8 × 10^{-39}$,$K_ sp[ Al(OH)_3] = 1.3 × 10^{-33}$,$K_ sp[ Mg(OH)_2] = 5.6 × 10^{-12}$;
ⅱ $2 Na[Al(OH)_4]( aq) \stackrel{ 加热}{\longrightarrow} Al_2 O_3 · 3 H_2 O(s) + 2 NaOH(aq)$。
回答下列问题:
(1) “滤渣”的主要成分为
SiO₂
(填化学式)。(2) $25° C$ 时,“碱沉”控制溶液 pH 至 3.0,此时溶液中 $c( Fe^{3+}) =$
2.8×10⁻⁶
$ mol· L^{-1}$。(3) “除杂”时需加入的试剂 X 是
NaOH
。(4) “水热合成”中,$ NH_4 H_2 PO_4$ 作为磷源,“滤液 2”的作用是
作钠源以及中和 H₃PO₄ 电离出的 H⁺
,水热合成 $ NaFePO_4$ 的离子方程式为H₃PO₄ + Fe²⁺ + Na⁺ + 2OH⁻ ══ NaFePO₄↓ + 2H₂O
。(5) “煅烧”得到的物质也能合成钠基正极材料 $ NaFeO_2$,其工艺如下:

① 该工艺经碳热还原得到 $ Fe_3 O_4$,“煅烧”生成 $ NaFeO_2$ 的化学方程式为
$4Fe₃O₄ + 6Na₂CO₃ + O₂ \xlongequal{高温} 12NaFeO₂ + 6CO₂$
。② $ NaFeO_2$ 的晶胞结构示意图如甲所示。每个晶胞中含有 $ NaFeO_2$ 的单元数有
3
个。③ 若“煅烧”温度为 $700° C$,$n( Na_2 CO_3):n( Fe_3 O_4) = 9:8$ 时,生成纯相 $ Na_{1-x} FeO_2$,则 $x =$
0.25
,其可能的结构示意图为乙
(选填“乙”或“丙”)。
答案:
4. 参考答案
(1) SiO₂
(2) 2.8×10⁻⁶
(3) NaOH
(4) 作钠源以及中和 H₃PO₄ 电离出的 H⁺ H₃PO₄ + Fe²⁺ + Na⁺ + 2OH⁻ ══ NaFePO₄↓ + 2H₂O
$(5) ①4Fe₃O₄ + 6Na₂CO₃ + O₂ \xlongequal{高温} 12NaFeO₂ + 6CO₂$
②3 ③0.25 乙
命题意图 本题考查制备 NaFePO₄ 和回收 Al₂O₃ 的工业流程,涉及沉淀溶解平衡、化学方程式的书写、晶胞结构与性质等知识,意在考查考生的综合分析推理能力,体现了“证据推理与模型认知”“变化观念与平衡思想”化学学科核心素养。
解题 思路
(1) “酸浸”时加入浓硫酸,SiO₂ 是酸性氧化物,不与浓硫酸反应,滤渣的主要成分为 SiO₂。
(2) 25℃时,控制溶液 pH 为 3.0,c(OH⁻) = 1×10⁻¹¹ mol·L⁻¹,此时$ c(Fe³⁺) = \frac{K_{sp}[Fe(OH)_3]}{c^3(OH^-)} = \frac{2.8×10^{-39}}{1×10^{-33}} = 2.8×10⁻⁶ mol·L⁻¹。$
(3) “碱沉”控制溶液 pH 至 3.0,滤液 1 中含有 Mg²⁺、Al³⁺,过量 X 的作用是将 Mg²⁺ 和 Al³⁺ 分离,且为产生 NaFePO₄ 提供钠源,因此 X 为 NaOH。
(4) 滤液 2 的主要溶质为 NaOH,可为“水热合成”NaFePO₄ 提供钠源,并中和 H₃PO₄ 电离出的 H⁺。水热合成 NaFePO₄ 的离子方程式为 H₂PO₄⁻ + Fe²⁺ + Na⁺ + 2OH⁻ ══ NaFePO₄↓ + 2H₂O。
(5) ①根据得失电子守恒、原子守恒,“焙烧”生成 NaFeO₂ 的化学方程式为$ 4Fe₃O₄ + 6Na₂CO₃ + O₂ \xlongequal{高温} 12NaFeO₂ + 6CO₂。$
②由均摊法计算题图甲晶胞中,$N(Fe) = 4×\frac{1}{4} + 2 = 3,$$N(Na) = 8×\frac{1}{8} + 2 = 3,$$N(O) = 8×\frac{1}{4} + 4 = 6,$每个晶胞中含有 NaFeO₂ 的单元数为 3。③n(Na₂CO₃) : n(Fe₃O₄) = 9 : 8 时,9Na₂CO₃ + 8Fe₃O₄ → Na₁₋ₓFeO₂,由 Fe 原子守恒可知,Na₁₋ₓFeO₂ 的化学计量数为 24,由 Na 原子守恒可知 24(1 - x) = 9×2,解得 x = 0.25。根据均摊法计算,图乙晶胞中$ N(Na) = 2×\frac{1}{8} + 2 = 2.25,$图丙晶胞中$ N(Na) = 6×\frac{1}{8} + 1 = 1.75,$根据 Na₀.₇₅FeO₂ 中 Na 与 Fe 的比例关系可得,Na₀.₇₅FeO₂ 晶胞中 N(Na) = 3×0.75 = 2.25,图乙符合题意。
(1) SiO₂
(2) 2.8×10⁻⁶
(3) NaOH
(4) 作钠源以及中和 H₃PO₄ 电离出的 H⁺ H₃PO₄ + Fe²⁺ + Na⁺ + 2OH⁻ ══ NaFePO₄↓ + 2H₂O
$(5) ①4Fe₃O₄ + 6Na₂CO₃ + O₂ \xlongequal{高温} 12NaFeO₂ + 6CO₂$
②3 ③0.25 乙
命题意图 本题考查制备 NaFePO₄ 和回收 Al₂O₃ 的工业流程,涉及沉淀溶解平衡、化学方程式的书写、晶胞结构与性质等知识,意在考查考生的综合分析推理能力,体现了“证据推理与模型认知”“变化观念与平衡思想”化学学科核心素养。
解题 思路
(1) “酸浸”时加入浓硫酸,SiO₂ 是酸性氧化物,不与浓硫酸反应,滤渣的主要成分为 SiO₂。
(2) 25℃时,控制溶液 pH 为 3.0,c(OH⁻) = 1×10⁻¹¹ mol·L⁻¹,此时$ c(Fe³⁺) = \frac{K_{sp}[Fe(OH)_3]}{c^3(OH^-)} = \frac{2.8×10^{-39}}{1×10^{-33}} = 2.8×10⁻⁶ mol·L⁻¹。$
(3) “碱沉”控制溶液 pH 至 3.0,滤液 1 中含有 Mg²⁺、Al³⁺,过量 X 的作用是将 Mg²⁺ 和 Al³⁺ 分离,且为产生 NaFePO₄ 提供钠源,因此 X 为 NaOH。
(4) 滤液 2 的主要溶质为 NaOH,可为“水热合成”NaFePO₄ 提供钠源,并中和 H₃PO₄ 电离出的 H⁺。水热合成 NaFePO₄ 的离子方程式为 H₂PO₄⁻ + Fe²⁺ + Na⁺ + 2OH⁻ ══ NaFePO₄↓ + 2H₂O。
(5) ①根据得失电子守恒、原子守恒,“焙烧”生成 NaFeO₂ 的化学方程式为$ 4Fe₃O₄ + 6Na₂CO₃ + O₂ \xlongequal{高温} 12NaFeO₂ + 6CO₂。$
②由均摊法计算题图甲晶胞中,$N(Fe) = 4×\frac{1}{4} + 2 = 3,$$N(Na) = 8×\frac{1}{8} + 2 = 3,$$N(O) = 8×\frac{1}{4} + 4 = 6,$每个晶胞中含有 NaFeO₂ 的单元数为 3。③n(Na₂CO₃) : n(Fe₃O₄) = 9 : 8 时,9Na₂CO₃ + 8Fe₃O₄ → Na₁₋ₓFeO₂,由 Fe 原子守恒可知,Na₁₋ₓFeO₂ 的化学计量数为 24,由 Na 原子守恒可知 24(1 - x) = 9×2,解得 x = 0.25。根据均摊法计算,图乙晶胞中$ N(Na) = 2×\frac{1}{8} + 2 = 2.25,$图丙晶胞中$ N(Na) = 6×\frac{1}{8} + 1 = 1.75,$根据 Na₀.₇₅FeO₂ 中 Na 与 Fe 的比例关系可得,Na₀.₇₅FeO₂ 晶胞中 N(Na) = 3×0.75 = 2.25,图乙符合题意。
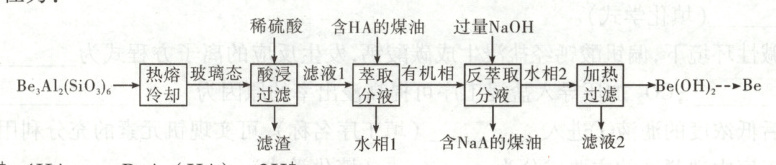
5. [2024·湖北卷,16T,13分] 铍用于宇航器件的构筑。一种从其铝硅酸盐 $[ Be_3 Al_2( SiO_3)_6]$ 中提取铍的路径为:
已知:$ Be^{2+} + 4 HA \rightleftharpoons BeA_2( HA)_2 + 2 H^+$
回答下列问题:
(1) 基态 $ Be^{2+}$ 的轨道表示式为
(2) 为了从“热熔、冷却”步骤得到玻璃态,冷却过程的特点是
(3) “萃取分液”的目的是分离 $ Be^{2+}$ 和 $ Al^{3+}$,向过量烧碱溶液中逐滴加入少量“水相 1”的溶液,观察到的现象是
(4) 写出反萃取生成 $ Na_2[ Be(OH)_4]$ 的化学方程式
(5) 电解熔融氯化铍制备金属铍时,加入氯化钠的主要作用是
(6) $ Be(OH)_2$ 与醋酸反应得到某含 4 个 Be 的配合物,4 个 Be 位于以 1 个 O 原子为中心的四面体的 4 个顶点,且每个 Be 的配位环境相同,Be 与 Be 间通过 $ CH_3 COO^-$ 相连,其化学式为

已知:$ Be^{2+} + 4 HA \rightleftharpoons BeA_2( HA)_2 + 2 H^+$
回答下列问题:
(1) 基态 $ Be^{2+}$ 的轨道表示式为
$\uparrow\downarrow$
。(2) 为了从“热熔、冷却”步骤得到玻璃态,冷却过程的特点是
快速冷却
。(3) “萃取分液”的目的是分离 $ Be^{2+}$ 和 $ Al^{3+}$,向过量烧碱溶液中逐滴加入少量“水相 1”的溶液,观察到的现象是
无明显现象
。(4) 写出反萃取生成 $ Na_2[ Be(OH)_4]$ 的化学方程式
BeA₂(HA)₂ + 6NaOH ══ Na₂[Be(OH)₄] + 4NaA + 2H₂O
。“滤液 2”可以进入“反萃取分液”
步骤再利用。(5) 电解熔融氯化铍制备金属铍时,加入氯化钠的主要作用是
增强熔融氯化铍的导电性
。(6) $ Be(OH)_2$ 与醋酸反应得到某含 4 个 Be 的配合物,4 个 Be 位于以 1 个 O 原子为中心的四面体的 4 个顶点,且每个 Be 的配位环境相同,Be 与 Be 间通过 $ CH_3 COO^-$ 相连,其化学式为
Be₄O(CH₃COO)₆
。
答案:
5. 参考答案$ (1) \uparrow\downarrow (2) $快速冷却
(3) 无明显现象
(4) BeA₂(HA)₂ + 6NaOH ══ Na₂[Be(OH)₄] + 4NaA + 2H₂O “反萃取分液”
(5) 增强熔融氯化铍的导电性
(6) Be₄O(CH₃COO)₆
命题意图 本题以提取铍的路径为素材,涉及轨道表示式、化学方程式的书写、分子结构等知识,意在考查考生的推理分析能力,体现了“证据推理与模型认知”“宏观辨识与微观探析”化学学科核心素养。
解题 思路 铝硅酸盐先加热熔融,然后快速冷却到其玻璃态,再加入稀硫酸“酸浸过滤”,“滤渣”的成分为 SiO₂,“滤液 1”中有 Be²⁺ 和 Al³⁺,加入含 HA 的煤油将 Be²⁺ 萃取到“有机相”中,“水相 1”中含有 Al³⁺,“有机相”为 BeA₂(HA)₂,加入过量 NaOH 反萃取 Be²⁺ 使其转化为 Na₂[Be(OH)₄] 进入“水相 2”中,通过分液分离出含 NaA 的煤油,最后对“水相 2”加热,使 Na₂[Be(OH)₄] 转化为 Be(OH)₂ 沉淀,过滤,分离出 Be(OH)₂,通过一系列操作得到金属铍。
(1) 基态 Be²⁺ 的电子排布式为 1s²,其轨道表示式为$ \uparrow\downarrow。$
(2) 熔融态物质冷却凝固时,缓慢冷却会形成晶体,快速冷却会形成非晶态,即玻璃态,所以从“热熔、冷却”步骤得到玻璃态,冷却过程的特点为快速冷却。
(3) “滤液 1”中有 Be²⁺ 和 Al³⁺,加入含 HA 的煤油将 Be²⁺ 萃取到“有机相”中,则“水相 1”中含有 Al³⁺,则向过量烧碱溶液中逐滴加入少量“水相 1”的溶液,发生的反应为 Al³⁺ + 4OH⁻ ══ [Al(OH)₄]⁻,可观察到为无明显现象。
(4) “滤液 2”的主要成分为 NaOH,可进入“反萃取分液”步骤再利用。
(5) 氯化铍的共价性较强,电解熔融氯化铍制备金属铍时,加入氯化钠的主要作用为增强熔融氯化铍的导电性。
(6) 由题意可知,该配合物中有 4 个 Be 位于四面体的四个顶点上,四面体中心只有 1 个 O,Be 与 Be 之间总共有 6 个 CH₃COO⁻,则其化学式为 Be₄O(CH₃COO)₆。
(3) 无明显现象
(4) BeA₂(HA)₂ + 6NaOH ══ Na₂[Be(OH)₄] + 4NaA + 2H₂O “反萃取分液”
(5) 增强熔融氯化铍的导电性
(6) Be₄O(CH₃COO)₆
命题意图 本题以提取铍的路径为素材,涉及轨道表示式、化学方程式的书写、分子结构等知识,意在考查考生的推理分析能力,体现了“证据推理与模型认知”“宏观辨识与微观探析”化学学科核心素养。
解题 思路 铝硅酸盐先加热熔融,然后快速冷却到其玻璃态,再加入稀硫酸“酸浸过滤”,“滤渣”的成分为 SiO₂,“滤液 1”中有 Be²⁺ 和 Al³⁺,加入含 HA 的煤油将 Be²⁺ 萃取到“有机相”中,“水相 1”中含有 Al³⁺,“有机相”为 BeA₂(HA)₂,加入过量 NaOH 反萃取 Be²⁺ 使其转化为 Na₂[Be(OH)₄] 进入“水相 2”中,通过分液分离出含 NaA 的煤油,最后对“水相 2”加热,使 Na₂[Be(OH)₄] 转化为 Be(OH)₂ 沉淀,过滤,分离出 Be(OH)₂,通过一系列操作得到金属铍。
(1) 基态 Be²⁺ 的电子排布式为 1s²,其轨道表示式为$ \uparrow\downarrow。$
(2) 熔融态物质冷却凝固时,缓慢冷却会形成晶体,快速冷却会形成非晶态,即玻璃态,所以从“热熔、冷却”步骤得到玻璃态,冷却过程的特点为快速冷却。
(3) “滤液 1”中有 Be²⁺ 和 Al³⁺,加入含 HA 的煤油将 Be²⁺ 萃取到“有机相”中,则“水相 1”中含有 Al³⁺,则向过量烧碱溶液中逐滴加入少量“水相 1”的溶液,发生的反应为 Al³⁺ + 4OH⁻ ══ [Al(OH)₄]⁻,可观察到为无明显现象。
(4) “滤液 2”的主要成分为 NaOH,可进入“反萃取分液”步骤再利用。
(5) 氯化铍的共价性较强,电解熔融氯化铍制备金属铍时,加入氯化钠的主要作用为增强熔融氯化铍的导电性。
(6) 由题意可知,该配合物中有 4 个 Be 位于四面体的四个顶点上,四面体中心只有 1 个 O,Be 与 Be 之间总共有 6 个 CH₃COO⁻,则其化学式为 Be₄O(CH₃COO)₆。
查看更多完整答案,请扫码查看


