2026年新高考5年真题高中化学全一册通用版广东专版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年新高考5年真题高中化学全一册通用版广东专版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第61页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
1. [2025 · 河南卷,4T,3 分] X 是自然界中一种常见矿物的主要成分,可以通过如图所示的四步反应转化为 Q(略去部分参与反应的物质和反应条件)。已知 X 和 Q 的组成元素相同。

下列说法错误的是 (
A.Y 常用作油漆、涂料等的红色颜料
B.溶液 Z 加热煮沸后颜色会发生变化
C.R→Q 反应需要在强酸性条件下进行
D.Q 可以通过单质间化合反应制备

下列说法错误的是 (
C
)A.Y 常用作油漆、涂料等的红色颜料
B.溶液 Z 加热煮沸后颜色会发生变化
C.R→Q 反应需要在强酸性条件下进行
D.Q 可以通过单质间化合反应制备
答案:
1 参考答案 C
命题意图 本题以矿物转化流程为情境,考查元素化合物性质及反应推断,体现了“证据推理与模型认知”等化学学科核心素养。
解题思路 X是自然界中一种常见矿物的主要成分,根据固体Y、Q和溶液Z、R的颜色以及X和Q的组成元素相同可知,X中含有铁元素。根据各物质颜色可知,X是FeS₂,Y是Fe₂O₃,溶液Z含有Fe³⁺、溶液R中含有Fe²⁺,Q是FeS。Fe₂O₃为红棕色固体,常用作油漆、涂料等的红色颜料,A项正确。溶液Z为含有Fe³⁺的溶液,经加热煮沸,Fe³⁺会水解生成Fe(OH)₃胶体,颜色会由棕黄色变为红褐色,B项正确。FeS可溶于强酸,所以R→Q反应不能在强酸性溶液中进行,可通过反应Fe²⁺+H₂S=FeS+2H⁺实现,H₂S为弱酸,C项错误。在加热条件下Fe和S化合生成FeS,D项正确。
命题意图 本题以矿物转化流程为情境,考查元素化合物性质及反应推断,体现了“证据推理与模型认知”等化学学科核心素养。
解题思路 X是自然界中一种常见矿物的主要成分,根据固体Y、Q和溶液Z、R的颜色以及X和Q的组成元素相同可知,X中含有铁元素。根据各物质颜色可知,X是FeS₂,Y是Fe₂O₃,溶液Z含有Fe³⁺、溶液R中含有Fe²⁺,Q是FeS。Fe₂O₃为红棕色固体,常用作油漆、涂料等的红色颜料,A项正确。溶液Z为含有Fe³⁺的溶液,经加热煮沸,Fe³⁺会水解生成Fe(OH)₃胶体,颜色会由棕黄色变为红褐色,B项正确。FeS可溶于强酸,所以R→Q反应不能在强酸性溶液中进行,可通过反应Fe²⁺+H₂S=FeS+2H⁺实现,H₂S为弱酸,C项错误。在加热条件下Fe和S化合生成FeS,D项正确。
2. [2025 · 云南卷,12T,3 分] Be 及其化合物的转化关系如图。下列说法错误的是 (
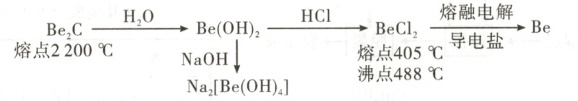
A.${Be(OH)2}$ 是两性氢氧化物
B.${Be2C}$ 和 ${BeCl2}$ 的晶体类型相同
C.${Na2[Be(OH)4]}$ 中 Be 原子的杂化方式为 $\mathrm{sp^3}$
D.${Be2C}$ 与 ${H2O}$ 反应:${Be2C + 4H2O = 2Be(OH)2 + CH4}\uparrow$
B
)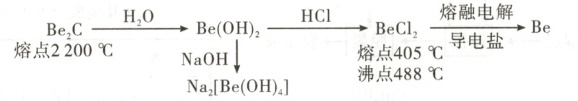
A.${Be(OH)2}$ 是两性氢氧化物
B.${Be2C}$ 和 ${BeCl2}$ 的晶体类型相同
C.${Na2[Be(OH)4]}$ 中 Be 原子的杂化方式为 $\mathrm{sp^3}$
D.${Be2C}$ 与 ${H2O}$ 反应:${Be2C + 4H2O = 2Be(OH)2 + CH4}\uparrow$
答案:
2 参考答案 B
命题意图 本题通过Be及其化合物的转化关系,考查两性氢氧化物、晶体类型等知识,意在强化考生对物质转化认知,体现了“证据推理与模型认知”等化学学科核心素养。
解题思路 由图中转化信息可知,Be(OH)₂既能与盐酸反应又能与氢氧化钠反应,故其是两性氢氧化物,A项正确。由题中信息可知,Be₂C的熔点远远高于BeCl₂,且BeCl₂的熔点和沸点均较低,同时电解熔融BeCl₂时需要加入导电盐,因此两者的晶体类型不相同,Be₂C为共价晶体,BeCl₂为分子晶体,B项错误。Na₂[Be(OH)₄]中Be原子与4个羟基形成4个σ键,没有孤电子对,Be的价层电子对数为4,其杂化方式为sp³,C项正确。Be₂C中的Be化合价为+2,C的化合价为-4,因此其发生水解反应生成Be(OH)₂和CH₄,该反应的化学方程式为Be₂C + 4H₂O=2Be(OH)₂+CH₄↑,D项正确。
命题意图 本题通过Be及其化合物的转化关系,考查两性氢氧化物、晶体类型等知识,意在强化考生对物质转化认知,体现了“证据推理与模型认知”等化学学科核心素养。
解题思路 由图中转化信息可知,Be(OH)₂既能与盐酸反应又能与氢氧化钠反应,故其是两性氢氧化物,A项正确。由题中信息可知,Be₂C的熔点远远高于BeCl₂,且BeCl₂的熔点和沸点均较低,同时电解熔融BeCl₂时需要加入导电盐,因此两者的晶体类型不相同,Be₂C为共价晶体,BeCl₂为分子晶体,B项错误。Na₂[Be(OH)₄]中Be原子与4个羟基形成4个σ键,没有孤电子对,Be的价层电子对数为4,其杂化方式为sp³,C项正确。Be₂C中的Be化合价为+2,C的化合价为-4,因此其发生水解反应生成Be(OH)₂和CH₄,该反应的化学方程式为Be₂C + 4H₂O=2Be(OH)₂+CH₄↑,D项正确。
3. [2025 · 甘肃卷,11T,3 分] 处理某酸浸液(主要含 $\mathrm{Li^+}$、$\mathrm{Fe^{2+}}$、$\mathrm{Cu^{2+}}$、$\mathrm{Al^{3+}}$)的部分流程如下:

下列说法正确的是 (
A.“沉铜” 过程中发生反应的离子方程式:$\mathrm{2Fe + 3Cu^{2+} = 3Cu + 2Fe^{3+}}$
B.“碱浸” 过程中 $\mathrm{NaOH}$ 固体加入量越多,$\mathrm{Al(OH)3}$ 沉淀越完全
C.“氧化” 过程中铁元素化合价降低
D.“沉锂” 过程利用了 $\mathrm{Li2CO3}$ 的溶解度比 $\mathrm{Na2CO3}$ 小的性质

下列说法正确的是 (
D
)A.“沉铜” 过程中发生反应的离子方程式:$\mathrm{2Fe + 3Cu^{2+} = 3Cu + 2Fe^{3+}}$
B.“碱浸” 过程中 $\mathrm{NaOH}$ 固体加入量越多,$\mathrm{Al(OH)3}$ 沉淀越完全
C.“氧化” 过程中铁元素化合价降低
D.“沉锂” 过程利用了 $\mathrm{Li2CO3}$ 的溶解度比 $\mathrm{Na2CO3}$ 小的性质
答案:
3 参考答案 D
命题意图 本题以处理某酸浸液的部分流程为情境,意在考查考生对流程的分析能力,掌握相关元素及其化合物的性质为解题关键,体现了“证据推理与模型认知”“宏观辨识与微观探析”等化学学科核心素养。
解题思路 “沉铜”过程中铁置换出铜单质,发生反应的离子方程式为Fe+Cu²⁺=Cu+Fe²⁺,A项错误。Al(OH)₃是两性氢氧化物,NaOH过量,则Al(OH)₃会转化为可溶于水的Na[Al(OH)₄],B项错误。“氧化”过程中将Fe²⁺氧化为Fe³⁺,形成Fe(OH)₃沉淀,铁元素化合价升高,C项错误。加入Na₂CO₃得到Li₂CO₃沉淀,利用了Li₂CO₃的溶解度比Na₂CO₃小的性质,D项正确。
命题意图 本题以处理某酸浸液的部分流程为情境,意在考查考生对流程的分析能力,掌握相关元素及其化合物的性质为解题关键,体现了“证据推理与模型认知”“宏观辨识与微观探析”等化学学科核心素养。
解题思路 “沉铜”过程中铁置换出铜单质,发生反应的离子方程式为Fe+Cu²⁺=Cu+Fe²⁺,A项错误。Al(OH)₃是两性氢氧化物,NaOH过量,则Al(OH)₃会转化为可溶于水的Na[Al(OH)₄],B项错误。“氧化”过程中将Fe²⁺氧化为Fe³⁺,形成Fe(OH)₃沉淀,铁元素化合价升高,C项错误。加入Na₂CO₃得到Li₂CO₃沉淀,利用了Li₂CO₃的溶解度比Na₂CO₃小的性质,D项正确。
4. [2025 · 北京卷,12T,3 分] 为研究三价铁配合物性质进行如下实验(忽略溶液体积变化)。
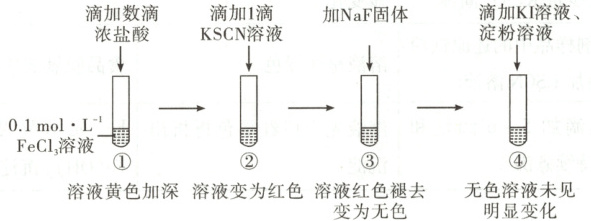
已知:$\mathrm{[FeCl4]^-}$ 为黄色、$\mathrm{[Fe(SCN)]^{2+}}$ 为红色、$\mathrm{[FeF6]^{3-}}$ 为无色。
下列说法不正确的是 (
A.①中浓盐酸促进 $\mathrm{Fe^{3+} + 4Cl^- \rightleftharpoons [FeCl4]^-}$ 平衡正向移动
B.由①到②,生成 $\mathrm{[Fe(SCN)]^{2+}}$ 并消耗 $\mathrm{[FeCl4]^-}$
C.②③对比,说明 $c\mathrm{(Fe^{3+})}$:②>③
D.由①→④推断,若向①深黄色溶液中加入 $\mathrm{KI}$、淀粉溶液,溶液也无明显变化

已知:$\mathrm{[FeCl4]^-}$ 为黄色、$\mathrm{[Fe(SCN)]^{2+}}$ 为红色、$\mathrm{[FeF6]^{3-}}$ 为无色。
下列说法不正确的是 (
D
)A.①中浓盐酸促进 $\mathrm{Fe^{3+} + 4Cl^- \rightleftharpoons [FeCl4]^-}$ 平衡正向移动
B.由①到②,生成 $\mathrm{[Fe(SCN)]^{2+}}$ 并消耗 $\mathrm{[FeCl4]^-}$
C.②③对比,说明 $c\mathrm{(Fe^{3+})}$:②>③
D.由①→④推断,若向①深黄色溶液中加入 $\mathrm{KI}$、淀粉溶液,溶液也无明显变化
答案:
4 参考答案 D
命题意图 本题以三价铁配合物性质的探究实验为情境,考查化学平衡与溶液中离子浓度相关知识,体现了“科学探究与创新意识”“变化观念与平衡思想”等化学学科核心素养。
解题思路 ①中滴加数滴浓盐酸,试管溶液黄色加深,结合[FeCl₄]⁻为黄色,说明浓盐酸促进Fe³⁺+4Cl⁻⇌[FeCl₄]⁻平衡正向移动,生成更多的[FeCl₄]⁻,A项正确。由①到②,溶液变为红色,说明Fe³⁺+SCN⁻⇌[Fe(SCN)]²⁺平衡正向移动,溶液中c(Fe³⁺)减小,使得Fe³⁺+4Cl⁻⇌[FeCl₄]⁻平衡逆向移动,即生成[Fe(SCN)]²⁺并消耗[FeCl₄]⁻,B项正确。向②所得溶液中加入KI、淀粉溶液,Fe³⁺会氧化I⁻生成I₂,溶液变蓝,D项错误。根据实验可知,①中Fe³⁺浓度较高,若向①深黄色溶液中加入KI、淀粉溶液,Fe³⁺会氧化I⁻生成I₂,溶液变蓝,D项错误。
命题意图 本题以三价铁配合物性质的探究实验为情境,考查化学平衡与溶液中离子浓度相关知识,体现了“科学探究与创新意识”“变化观念与平衡思想”等化学学科核心素养。
解题思路 ①中滴加数滴浓盐酸,试管溶液黄色加深,结合[FeCl₄]⁻为黄色,说明浓盐酸促进Fe³⁺+4Cl⁻⇌[FeCl₄]⁻平衡正向移动,生成更多的[FeCl₄]⁻,A项正确。由①到②,溶液变为红色,说明Fe³⁺+SCN⁻⇌[Fe(SCN)]²⁺平衡正向移动,溶液中c(Fe³⁺)减小,使得Fe³⁺+4Cl⁻⇌[FeCl₄]⁻平衡逆向移动,即生成[Fe(SCN)]²⁺并消耗[FeCl₄]⁻,B项正确。向②所得溶液中加入KI、淀粉溶液,Fe³⁺会氧化I⁻生成I₂,溶液变蓝,D项错误。根据实验可知,①中Fe³⁺浓度较高,若向①深黄色溶液中加入KI、淀粉溶液,Fe³⁺会氧化I⁻生成I₂,溶液变蓝,D项错误。
查看更多完整答案,请扫码查看


